摘要: 物质X与Y充分化合.可得到Z,X与CuO反应.也有Z生成.请根据以上信息作出推测:如果X是单质固体.则X是 .X与CuO反应的化学方程式 .
网址:http://m.1010jiajiao.com/timu3_id_1630[举报]
物质X与Y充分化合,可得到Z;X与CuO反应,也有Z生成.请根据以上信息作出推测:
(1)如果X是单质固体,则X是(写化学式)_________________;
(2)如果X是氧化物,则X是(写化学式)_________________.
查看习题详情和答案>>
活性氧化锌(ZnO) 是一种面向21世纪的新型高功能精细无机产品。用粗ZnO制备活性ZnO的生产工艺流程做如下图所示。
I制备活性氧化锌
一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如下:
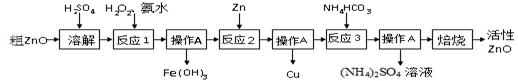
【查阅资料】
1、粗ZnO中常含杂质FeO、CuO
2、反应3是为了制得碱式碳酸锌、碱式碳酸锌经焙烧可制得活性ZnO
3、已知:几种物质沉淀时的pH如下表:
【问题讨论】
(1)溶解前将氧化锌粗品粉碎成细颗粒,目的是___________ __________ _ 。
(2)写出ZnO与加稀硫酸反应的化学方程式 。
(3)反应1的目的将Fe2+氧化为Fe3+,并完全沉淀Fe(OH)3 ,为了暂不形成Cu(OH)2、Zn(OH)2 ,该步骤需控制溶液pH的范围是 ,操作A的名称是 。
(4)反应2中加入锌发生的反应属于 反应(填化学反应的基本类型)。
Ⅱ测定碱式碳酸锌的化学式
碱式碳酸锌的化学式是xZnCO3?yZn(OH)2?zH2O,用下列装置测定碱式碳酸锌的化学组成。(假设每步反应、吸收均完全)
提示:碱式碳酸锌xZnCO3?yZn(OH)2?zH2O受热分解为ZnO、H2O、CO2三种产物,其中
ZnCO3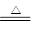 ZnO+CO2↑ Zn(OH)2
ZnO+CO2↑ Zn(OH)2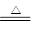 ZnO+H2O
ZnO+H2O
【实验步骤】
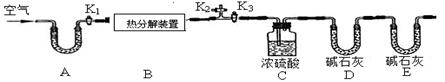
①按图连接好装置,并检查装置的 ;
②在热分解装置中装入68.2g样品,打开活塞 ,关闭 ,缓缓鼓入空气数分钟;
③称量装置C、D的质量;
④关闭活塞K1,K2,打开K3,启动热分解装置,使样品充分热解;
⑤停止加热,继续通空气至装置冷却到室温; ⑥再次分别称量装置C、D的质量.
【记录数据】该小组同学按上述实验步骤进行实验,并记录了如下数据:
【实验分析及数据处理】
(1)A处干燥管盛放的药品是碱石灰(CaO与NaOH的固体混合物),其作用是 。
(2)第⑤步继续通空气的目的是 。
(3)E处碱石灰的作用是 ,若没有此装置,测得二氧化碳的质量 (填“偏大”、“偏小”或“无影响”)。
(4)根据上述数据,计算xZnCO3?yZn(OH)2?zH2O中x:y:z的最简比=
该碱式碳酸锌受热分解的化学方程式为 。
I制备活性氧化锌
一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如下:

【查阅资料】
1、粗ZnO中常含杂质FeO、CuO
2、反应3是为了制得碱式碳酸锌、碱式碳酸锌经焙烧可制得活性ZnO
3、已知:几种物质沉淀时的pH如下表:
| 物质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
| 开始沉淀时pH | 6.34 | 1.48 | 6.2 | 5.2 |
| 完全沉淀时pH | 9.7 | 3.2 | 8.0 | 6.4 |
| Fe(OH)2是一种絮状沉淀,不易除去,处理时常将其转化为Fe(OH)3而除去。 | ||||
【问题讨论】
(1)溶解前将氧化锌粗品粉碎成细颗粒,目的是___________ __________ _ 。
(2)写出ZnO与加稀硫酸反应的化学方程式 。
(3)反应1的目的将Fe2+氧化为Fe3+,并完全沉淀Fe(OH)3 ,为了暂不形成Cu(OH)2、Zn(OH)2 ,该步骤需控制溶液pH的范围是 ,操作A的名称是 。
(4)反应2中加入锌发生的反应属于 反应(填化学反应的基本类型)。
Ⅱ测定碱式碳酸锌的化学式
碱式碳酸锌的化学式是xZnCO3?yZn(OH)2?zH2O,用下列装置测定碱式碳酸锌的化学组成。(假设每步反应、吸收均完全)
提示:碱式碳酸锌xZnCO3?yZn(OH)2?zH2O受热分解为ZnO、H2O、CO2三种产物,其中
ZnCO3
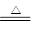 ZnO+CO2↑ Zn(OH)2
ZnO+CO2↑ Zn(OH)2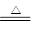 ZnO+H2O
ZnO+H2O 【实验步骤】

①按图连接好装置,并检查装置的 ;
②在热分解装置中装入68.2g样品,打开活塞 ,关闭 ,缓缓鼓入空气数分钟;
③称量装置C、D的质量;
④关闭活塞K1,K2,打开K3,启动热分解装置,使样品充分热解;
⑤停止加热,继续通空气至装置冷却到室温; ⑥再次分别称量装置C、D的质量.
【记录数据】该小组同学按上述实验步骤进行实验,并记录了如下数据:
| | 装置C的质量(/g) | 装置D的质量(/g) |
| 实验前 | 198.4 | 235.7 |
| 实验后 | 209.2 | 244.5 |
(1)A处干燥管盛放的药品是碱石灰(CaO与NaOH的固体混合物),其作用是 。
(2)第⑤步继续通空气的目的是 。
(3)E处碱石灰的作用是 ,若没有此装置,测得二氧化碳的质量 (填“偏大”、“偏小”或“无影响”)。
(4)根据上述数据,计算xZnCO3?yZn(OH)2?zH2O中x:y:z的最简比=
该碱式碳酸锌受热分解的化学方程式为 。
 碱式碳酸镁密度小,是橡胶制品的优良填料.其组成一般以xMgCO3?yMg(OH)2?zH2O表示.
碱式碳酸镁密度小,是橡胶制品的优良填料.其组成一般以xMgCO3?yMg(OH)2?zH2O表示.【探究一】碱式碳酸镁的制备
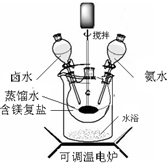
碱式碳酸镁可用复盐MgCO3?(NH4)2CO3?H2O作原料制备.取一定量的该复盐放入三颈烧瓶中,并将三颈烧瓶放在恒温水浴锅中加热(如图所示),按一定的液固比加入蒸馏水,开启搅拌器同时加入预定的氨水,待温度到达 40℃时开始分解,此时滴加卤水(氯化镁溶液)并继续滴入氨水,保持10分钟,一段时间后过滤洗涤,滤出的固体在120℃干燥得到碱式碳酸镁产品.
回答下列问题:
(1)①搅拌的目的是
反应物充分混合接触,提高反应速率
反应物充分混合接触,提高反应速率
;②选择水浴加热方式,其优点是反应物均匀受热
反应物均匀受热
.(2)所得碱式碳酸镁产品中常检出有少量Cl-,其原因是混有
NH4Cl
NH4Cl
(填化学式).(3)设计实验检验碱式碳酸镁中含有Cl-
| 实验操作 | 实验现象 | 实验结论 |
| ①取样溶解,向样品溶液中滴加过量稀硝酸. ②再向上述所得溶液加 硝酸银或AgNO3 硝酸银或AgNO3 溶液 |
现象① 产生气泡 产生气泡 ;现象② 产生白色沉淀 产生白色沉淀 ; |
含有 Cl- |
300℃
已知:碱式碳酸镁分解反应方程式为:xMgCO3?yMg(OH)2?zH2O
| ||
探究小组利用下图测定xMgCO3?yMg(OH)2?zH2O组成.
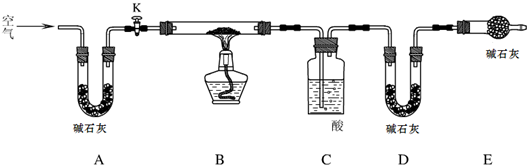
实验步骤:
步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中.
步骤2:打开活塞K,鼓入空气,一段时间后关闭,称量相关装置的质量.
步骤3:加热装置B直至装置C中无气泡产生.
步骤4:
打开活塞K,再次鼓入空气
打开活塞K,再次鼓入空气
(请补充该步操作内容).步骤5:称量相关装置的质量.
某同学在实验过程中采集了如下数据:
A.反应前玻璃管的质量100.0g
B.反应后玻璃管与残留固体总质量120.0g
C.装置C实验后增重9.0g
D.装置D实验后增重17.6g
回答下列问题:
(1)检查整套实验装置气密性的方法如下:将装置A的左端、装置E的右端分别接上导管,放入盛有水的烧杯中,
打开活塞K开关
打开活塞K开关
,对装置B用酒精灯微热,观察,若若两端导管口处均出现气泡
若两端导管口处均出现气泡
,则气密性良好;(2)如果没有装置A,则测定得到的Z值
偏大
偏大
(填“偏大”、“偏小”、“无影响”),装置C中的酸为
浓硫酸
浓硫酸
(写名称);(3)根据实验测定的数据,求出碱式碳酸铜(xMgCO3?yMg(OH)2?zH2O)
中x:y:z=
4:1:4
4:1:4
(要求写出过程).【交流反思】
(4)如果不称量装置C实验前后的增重,要根据实验数据,求出x:y:z的值,还可测量的实验数据是
样品的质量
样品的质量
.氢氧化钠固体及溶液在空气中很容易发生变质生成碳酸钠.
(1)甲同学在实验室里发现一瓶敞口放置的氢氧化钠溶液,对其变质情况进行了如下探究.
【猜想与假设】该氢氧化钠溶液已部分变质.
【实验与结论】
【拓展探究】甲同学又尝试通过实验除去该氢氧化钠溶液中含有的碳酸钠,方案如下:
向该溶液中加入
(2)乙同学在实验室里发现少量部分变质的氢氧化钠固体,尝试通过实验测定其中碳酸钠的质量分数.
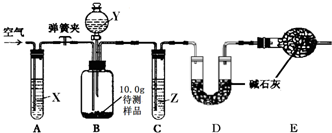
【设计和进行实验】乙同学设计了如图所示的实验装置(铁架台、铁夹等固定用装置已略去,碱石灰是固体氢氧化钠和生石灰的混合物).取10.0g待测样品,进行实验.实验步骤如下:
a.连接好装置,并检查气密性;
b.打开弹簧夹,缓缓通入一段时间空气;
c.称量装置D的质量为83.4g;
d.关闭弹簧夹,慢慢滴加Y溶液,至不再产生气泡为止;
e.打开弹簧夹,再次缓缓通入一段时间空气;
f.再次称量装置D的质量为84.5g.
【交流讨论】
①试剂X、Y、Z依次最适宜选用
A.氢氧化钠溶液 浓盐酸 浓硫酸 B.澄清石灰水 稀盐酸 稀硫酸
C.氢氧化钠溶液 稀硫酸 浓硫酸 D.浓硫酸 稀硫酸 氢氧化钠溶液
②步骤e中通入空气的作用是
③若没有装置C,则会导致测定结果
【交流讨论】根据实验中测得的有关数据,计算部分变质的氢氧化钠固体中碳酸钠的质量分数.
查看习题详情和答案>>

(1)甲同学在实验室里发现一瓶敞口放置的氢氧化钠溶液,对其变质情况进行了如下探究.
【猜想与假设】该氢氧化钠溶液已部分变质.
【实验与结论】
| 实验步骤 | 实验现象 | 实验结论 |
| a.取少量该溶液于一支试管中,加入 足量的氯化钙溶液 足量的氯化钙溶液 |
有白色沉淀生成 有白色沉淀生成 |
该氢氧化钠溶液已变质 |
| b.将步骤a所得的液体静置,取上层清液于另一支试管中,滴加 无色酚酞试液 无色酚酞试液 |
酚酞试液变红 酚酞试液变红 |
该氢氧化钠溶液已部分变质 |
向该溶液中加入
氢氧化钙
氢氧化钙
,充分反应后,经过滤
过滤
操作,即可除去该氢氧化钠溶液中含有的杂质.(2)乙同学在实验室里发现少量部分变质的氢氧化钠固体,尝试通过实验测定其中碳酸钠的质量分数.
【设计和进行实验】乙同学设计了如图所示的实验装置(铁架台、铁夹等固定用装置已略去,碱石灰是固体氢氧化钠和生石灰的混合物).取10.0g待测样品,进行实验.实验步骤如下:
a.连接好装置,并检查气密性;
b.打开弹簧夹,缓缓通入一段时间空气;
c.称量装置D的质量为83.4g;
d.关闭弹簧夹,慢慢滴加Y溶液,至不再产生气泡为止;
e.打开弹簧夹,再次缓缓通入一段时间空气;
f.再次称量装置D的质量为84.5g.
【交流讨论】
①试剂X、Y、Z依次最适宜选用
C
C
(选填字母).A.氢氧化钠溶液 浓盐酸 浓硫酸 B.澄清石灰水 稀盐酸 稀硫酸
C.氢氧化钠溶液 稀硫酸 浓硫酸 D.浓硫酸 稀硫酸 氢氧化钠溶液
②步骤e中通入空气的作用是
将B中产生的二氧化碳全部赶到D装置中
将B中产生的二氧化碳全部赶到D装置中
.③若没有装置C,则会导致测定结果
偏大
偏大
(选填“偏大”、“偏小”或“无影响”,下同);若没有装置E,则会导致测定结果偏大
偏大
.【交流讨论】根据实验中测得的有关数据,计算部分变质的氢氧化钠固体中碳酸钠的质量分数.
氢氧化钠固体及溶液在空气中很容易发生变质生成碳酸钠.
(1)甲同学在实验室里发现一瓶敞口放置的氢氧化钠溶液,对其变质情况进行了如下探究.
【猜想与假设】该氢氧化钠溶液已部分变质.
【实验与结论】
【拓展探究】甲同学又尝试通过实验除去该氢氧化钠溶液中含有的碳酸钠,方案如下:
向该溶液中加入
(2)乙同学在实验室里发现少量部分变质的氢氧化钠固体,尝试通过实验测定其中碳酸钠的质量分数.
【设计和进行实验】乙同学设计了下图所示的实验装置(铁架台、铁夹等固定用装置已略去,碱石灰是固体氢氧化钠和生石灰的混合物).取10.0g待测样品,进行实验.

实验步骤如下:
a.连接好装置,并检查气密性; b.打开弹簧夹,缓缓通入一段时间空气;
c.称量装置D的质量为83.4g; d.关闭弹簧夹,慢慢滴加Y溶液,至不再产生气泡为止;
e.打开弹簧夹,再次缓缓通入一段时间空气; f.再次称量装置D的质量为84.5g.
【交流讨论】
①试剂X、Y、Z依次最适宜选用
A.氢氧化钠溶液 浓盐酸 浓硫酸 B.澄清石灰水 稀盐酸 稀硫酸
C.氢氧化钠溶液 稀硫酸 浓硫酸 D.浓硫酸 稀硫酸 氢氧化钠溶液
②步骤e中通入空气的作用是
③若没有装置C,则会导致测定结果
查看习题详情和答案>>
(1)甲同学在实验室里发现一瓶敞口放置的氢氧化钠溶液,对其变质情况进行了如下探究.
【猜想与假设】该氢氧化钠溶液已部分变质.
【实验与结论】
| 实验步骤 | 实验现象 | 实验结论 |
| a.取少量该溶液于一支试管中,加入 过量的氯化钙溶液,并不断振荡 过量的氯化钙溶液,并不断振荡 |
产生白色沉淀 产生白色沉淀 |
该氢氧化钠溶液已变质 |
| b.将步骤a所得的液体静置,取上层清液于另一支试管中,滴加 酚酞试液 酚酞试液 |
溶液变成红色 溶液变成红色 |
该氢氧化钠溶液已部分变质 |
向该溶液中加入
氢氧化钙溶液
氢氧化钙溶液
,充分反应后即可除去该氢氧化钠溶液中含有的杂质.(2)乙同学在实验室里发现少量部分变质的氢氧化钠固体,尝试通过实验测定其中碳酸钠的质量分数.
【设计和进行实验】乙同学设计了下图所示的实验装置(铁架台、铁夹等固定用装置已略去,碱石灰是固体氢氧化钠和生石灰的混合物).取10.0g待测样品,进行实验.

实验步骤如下:
a.连接好装置,并检查气密性; b.打开弹簧夹,缓缓通入一段时间空气;
c.称量装置D的质量为83.4g; d.关闭弹簧夹,慢慢滴加Y溶液,至不再产生气泡为止;
e.打开弹簧夹,再次缓缓通入一段时间空气; f.再次称量装置D的质量为84.5g.
【交流讨论】
①试剂X、Y、Z依次最适宜选用
C
C
(选填字母).A.氢氧化钠溶液 浓盐酸 浓硫酸 B.澄清石灰水 稀盐酸 稀硫酸
C.氢氧化钠溶液 稀硫酸 浓硫酸 D.浓硫酸 稀硫酸 氢氧化钠溶液
②步骤e中通入空气的作用是
将B中产生的二氧化碳全部赶到D装置中
将B中产生的二氧化碳全部赶到D装置中
.③若没有装置C,则会导致测定结果
偏大
偏大
(选填“偏大”、“偏小”或“无影响”).