网址:http://m.1010jiajiao.com/timu3_id_162747[举报]
(1)开始瞬间反应速率的大小关系为 。?
(2)三个锥形瓶中加入锌粒的质量大小关系为: 。?
(3)反应终了所需的时间为 。?
(4)简要说明反应过程中甲、乙、丙速率不同的理由是 。
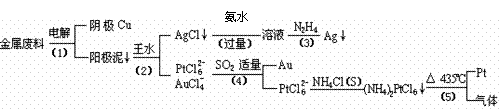
查看习题详情和答案>>(10分)从含银、锌、金和铂的金属铜废料中提取金、银、铂的一种工艺如下:高考资源网
(王水:浓硝酸与浓盐酸的混合物)高考资源网
 高考资源网
高考资源网
高考资
根据以上工艺回答下列问题:
(1)电解时,以铜金属废料为阳极,纯铜为阴极,CuSO4溶液为电解液,写出阳极电极反应方程式: 。
(2)肼(N2H4)是火箭发射常用的一种液体燃料,其完全燃烧时生成两种无污染的气体。已知部分共价键的键能数据如下表:
化学键 | N-N | O=O | N≡N | O-H | N-H |
键能/kJ?mol-1 | 193 | 499 | 941 | 460 | 393 |
则肼完全燃烧时的热化学方程式为: ;
(3)写出步骤(4)的离子反应方程式: ;
(4)金和浓硝酸反应的化学方程式为:Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O。但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,试简要解释原因: 。
(5)已知室温下(NH4)2PtCl6的Ksp约为9×10-6。步骤(4)所得溶液中PtCl62-浓度为1×10-4mol?L- 1,则要从1 m3的该溶液中开始析出(NH4)2PtCl6沉淀至少需加入NH4Cl固体的质量为 kg。(设溶液体积的变化忽略不计)
查看习题详情和答案>>(11分)使用启普发生器制取气体,具有随时可控制反应进行和停止的优点。某化学兴趣小组制作了如图所示的装置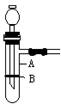 ,代替启普发生器。
,代替启普发生器。
(1)图中A仪器的名称是 ,缺少的仪器是 ,
(2)制作B使用的是( )
A、铁片 B、铝箔 C、纸片 D、塑料片
(3)在该装置中用下列反应制气体,反应原理可行,且可能达到上述优点的是( )
A、Na2CO3·10H2O+HCl→CO2↑ B、Cu+H2SO4→H2↑ C、CaCO3+HNO3→CO2↑
(4)若用该装置进行锌粒与稀硫酸反应制取氢气的实验;对装置作气密性检查的方法是 ,
(5)向装置中加入锌粒的方法是 。
(6)当需反应停止时的操作和发生的现象是 。
查看习题详情和答案>>
(11分)使用启普发生器制取气体,具有随时可控制反应进行和停止的优点。某化学兴趣小组制作了如图所示的装置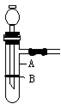 ,代替启普发生器。
,代替启普发生器。
(1)图中A仪器的名称是 ,缺少的仪器是 ,
(2)制作B使用的是( )
A、铁片 B、铝箔 C、纸片 D、塑料片
(3)在该装置中用下列反应制气体,反应原理可行,且可能达到上述优点的是( )
A、Na2CO3·10H2O+HCl→CO2↑ B、Cu+H2SO4→H2↑ C、CaCO3+HNO3→CO2↑
(4)若用该装置进行锌粒与稀硫酸反应制取氢气的实验;对装置作气密性检查的方法是 ,
(5)向装置中加入锌粒的方法是 。
(6)当需反应停止时的操作和发生的现象是 。
查看习题详情和答案>>
(11分)使用启普发生器制取气体,具有随时可控制反应进行和停止的优点。某化学兴趣小组制作了如图所示的装置 ,代替启普发生器。
,代替启普发生器。
(1)图中A仪器的名称是 ,缺少的仪器是 ,
(2)制作B使用的是( )
A、铁片 B、铝箔 C、纸片 D、塑料片
(3)在该装置中用下列反应制气体,反应原理可行,且可能达到上述优点的是( )
A、Na2CO3·10H2O+HCl→CO2↑ B、Cu+H2SO4→H2↑ C、CaCO3+HNO3→CO2↑
(4)若用该装置进行锌粒与稀硫酸反应制取氢气的实验;对装置作气密性检查的方法是 ,
(5)向装置中加入锌粒的方法是 。
(6)当需反应停止时的操作和发生的现象是 。