摘要:26.硫酸银的溶解度极小.25℃时.每100g水仅溶解0.836g. (1)25℃时.在烧杯中放入6.25g硫酸银固体.加200g水.经充分溶解后.所得饱和溶液的体积为200mL.计算溶液中Ag+离子物质的量浓度? (2)若上述烧杯中加入50.0mL 0.0268mol/L氯化钡溶液.充分搅拌.求溶液中Ag+离子的物质的量浓度. 题所述的烧杯中需加入多少升 0.0200mol/L氯化钡溶液.才能使原溶液中Ag+浓度降至0.0200mol/L?
网址:http://m.1010jiajiao.com/timu3_id_162705[举报]
硫酸银的溶解度较小,25℃时,每100g水仅溶解0.836g。
(1)25℃时,在烧杯中放入 6.24克硫酸银固体,加200克水,经充分溶解后,所得饱和溶液的体积为 200mL,计算溶液中Ag+的物质的量浓度。
(2)若在上述烧杯中加入50mL0.0268 mol/LBaCl2溶液,充分搅拌,溶液中Ag+的物质的量浓度是多少?
(3)在(1)题烧杯中需加入多少L 0.0268 mol/L BaCl2溶液,才能使原溶液中Ag+浓度降低至0.0200 mol/L
查看习题详情和答案>>硫酸银的溶解度较小,25℃时,每100g水仅溶解0.836g。
(1)25℃时,在烧杯中放入6.24g硫酸银固体,加200g水,经充分溶解后,所得饱和溶液的体积为
200mL。计算溶液中Ag+的物质的量浓度。
(2)若在上述烧杯中加入50 mL 0.0268 mol/L BaCl2溶液,充分搅拌,溶液中Ag+的物质的量浓度是多少?
(3)在(1)题烧杯中需加入多少升0.0268mol/L BaCl2溶液,才能使原溶液中Ag+浓度降低至0.0200mol/L?
查看习题详情和答案>>
(1)25℃时,在烧杯中放入6.24g硫酸银固体,加200g水,经充分溶解后,所得饱和溶液的体积为
200mL。计算溶液中Ag+的物质的量浓度。
(2)若在上述烧杯中加入50 mL 0.0268 mol/L BaCl2溶液,充分搅拌,溶液中Ag+的物质的量浓度是多少?
(3)在(1)题烧杯中需加入多少升0.0268mol/L BaCl2溶液,才能使原溶液中Ag+浓度降低至0.0200mol/L?
硫酸银的溶解度较小,25℃时,每100g水仅溶解0.836 g。
(1) 25℃时,在烧杯中放入 6.24g硫酸银固体,加200 g水,经充分溶解后,所得饱和溶液的体积为200 mL。计算溶液中Ag+的物质的量浓度。
(2) 若在上述烧杯中加入50 mL 0.0268 mol / L BaCl2溶液,充分搅拌,溶液中Ag+的物质的量浓度是多少?
(3) 在(1)题烧杯中需加入多少升0.0268 mol / L BaCl2溶液,才能使原溶液中Ag+浓度降低至0.0200 mol / L?
查看习题详情和答案>>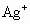 的物质的量浓度.
的物质的量浓度.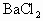 溶液,充分搅拌,溶液中的
溶液,充分搅拌,溶液中的