网址:http://m.1010jiajiao.com/timu3_id_162623[举报]
下列关于化学键的说法正确的是:
A.共价键是原子间通过共用电子对所形成的相互作用
B.离子键是阴、阳离子通过静电吸引形成的
C.化学键只存在于阴离子和阳离子之间
D.构成单质分子的微粒一定含有共价键
查看习题详情和答案>>| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| 电负性值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(1)通过分析电负性值变化规律,确定Mg元素电负性值的最小范围______;
(2)请归纳元素的电负性和金属、非金属的关系是______;
(3)COCl2俗称光气,分子中C原子以______杂化轨道方式与其它原子成键;分子结构中含有C-Cl键,其共用电子对偏向______(写原子名称).
(4)氯和硅元素形成的化合物SiCl4为共价化合物,它与氨气一起使用可用于海上军事作战起烟幕作用,试说明原因并写出相应发生的化学反应方程式:______;
(5)从电负性角度,判断AlCl3是离子化合物还是共价化合物?请说出理由(即写出判断的方法和结论)是:______;请设计一个实验方案证明上述所得到的结论:______.
查看习题详情和答案>>
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| 电负性值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(1)通过分析电负性值变化规律,确定Mg元素电负性值的最小范围
(2)请归纳元素的电负性和金属、非金属的关系是
(3)COCl2俗称光气,分子中C原子以
(4)氯和硅元素形成的化合物SiCl4为共价化合物,它与氨气一起使用可用于海上军事作战起烟幕作用,试说明原因并写出相应发生的化学反应方程式:
(5)从电负性角度,判断AlCl3是离子化合物还是共价化合物?请说出理由(即写出判断的方法和结论)是:
下列有关化学键、氢键和范德华力的叙述中,不正确的是( )
A.金属键是金属阳离子与“电子气”之间的较强作用,金属键无方向性和饱和性
B.共价键是原子之间通过共用电子对形成的化学键,共价键有方向性和饱和性
C.范德华力是分子间存在的一种作用力,分子的极性越大,范德华力越大
D.氢键不是化学键而是分子间的一种作用力,所以氢键只存在于分子与分子之间
查看习题详情和答案>>(1)CH3+ 、-CH3(甲基)、CH3-都是重要的有机反应中间体,有关它们的说法正确的是
A.它们均由甲烷去掉一个氢原子所得
B.它们互为等电子体,碳原子均采取sp2杂化
C.CH3-与NH3、H2O+互为等电子体,几何构型均为三角锥形
D.CH3+中的碳原子采取sp2杂化,所有原子均共面
E.两个-CH3(甲基)或一个CH3+和一个CH3-结合均可得到CH3CH3
(2)锌是一种重要的金属,锌及其化合物有着广泛的应用。
①锌在元素周期表中的位置是:_ 。
②葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。写出Zn2+基态电子排布式 ,葡萄糖分子[CH2OH(CHOH)4CHO]中碳原子杂化方式有 。
③Zn2+能与NH3形成配离子[Zn(NH3)4]2+。配位体NH3分子属于 (填“极性分子”或“非极性分子”);在〔Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在左下图中表示出[Zn(NH3)4]2+中Zn2+与N之间的化学键。
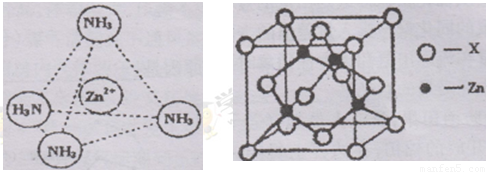
④右上图示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的Zn与X的原子个数之比为 。
⑤在④的晶胞(右上图)中,如果只考查X的排列方式,则X的堆积方式属于金属晶体堆积方式中的___ 堆积;设该晶胞中Zn的半径为r1 cm,其相对原子质量为M1,X的半径为r2cm,其相对原子质量为M2,则该晶体的密度为_ g/cm3 (写出含有字母的表达式)。
查看习题详情和答案>>