网址:http://m.1010jiajiao.com/timu3_id_162609[举报]
完成下列问题:
(1)门捷列夫提出元素周期律,研究元素性质周期性变化时,当时主要是按下列叙述中的哪个顺序排列的( )
①原子序数的递增 ②相对原子质量的递增 ③核外电子排布 ④质子数递增
A.① B.② C.①③ D.①③④
(2)元素周期律的真正基础不是元素的相对原子质量,而是原子序数,也就是原子的核电荷数(或者质子数)。你是如何解释后者比前者更合理的?
(3)门捷列夫提出的元素周期律的基础虽然不是最科学的,但也解释和预测了许多事实,你认为最可能的原因是什么?
查看习题详情和答案>>不同元素的原子在分子内吸引电子的能力大小可用x表示,x越大,其原子吸引电子的能力越强,在所形成的分子中成为带负电荷的一方.下面是某些短周期元素的x值.
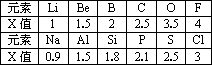
(1)通过分析x值的变化规律,确定Mg、N的x值范围
Mg:________、N:________.
(2)短周期元素x值的变化特点体现了元素性质的________变化规律.
(3)某有机物分子中含有S-N键,你认为电子对偏向________原子(填元素符号).
(4)经验规律告诉我们,当成键的两原子相应元素的x差值Δx大于1.7时一般形成离子键,Δx小于1.7时一般形成共价键,试预测:AlBr3中化学键的类型是________.
设计实验验证你的预测________.
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |




(2)①②③三种元素的气态氢化物的稳定性由强到弱的顺序是
(3)某同学设计并进行实验,探究元素④⑤⑥金属性递变规律,请将实验报告补充完全.
| 实验步骤 | 实验现象 |
| 1.将一小块④的单质放入滴有酚酞溶液的冷水中 | 钠浮在水面上,熔成小球,四处游动 钠浮在水面上,熔成小球,四处游动 ,发出嘶嘶响声,逐渐消失,溶液变成红色 |
| 2.将少量冷水注入盛有打磨过的⑤的单质的试管中,再滴加酚酞,一段时间后加热至沸腾 | 加热后 镁条表面产生无色气泡,溶液呈红色 镁条表面产生无色气泡,溶液呈红色 |
| 3.将2mL 1mol/L盐酸加入盛有打磨过的⑤的单质的试管中 | 剧烈反应,迅速产生大量无色气泡 |
| 4.将2mL 1mol/L盐酸加入盛有打磨过的 Al Al 的单质的试管中 |
反应缓慢,一段时间后,产生无色气泡 |
| 结论: Na、Mg、Al三种元素的金属性依次减弱 Na、Mg、Al三种元素的金属性依次减弱 (用元素符号结合文字说明) | |
| 动手实践:某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系)。 | ||||||||||||||
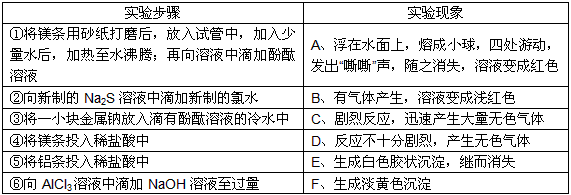 | ||||||||||||||
| 请你帮助该同学整理并完成实验报告。 (1)实验目的:研究___________________元素性质递变规律。 实验用品:试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlCl3溶液,NaOH溶液,酚酞溶液等。仪器:略。 (2)实验内容:(填写与实验步骤对应的实验现象的编号和①②的化学方程式) | ||||||||||||||
| ||||||||||||||
| ①___________________, ②________________________。 (3)实验结论:_______________________________。 |
动手实践:某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见表,表中的“实验步骤”与“实验现象”前后不一定是对应的关系).

请你帮助该同学整理并完成实验报告.
(1)实验目的:研究________元素性质递变规律.
(2)实验用品:
试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlCl3溶液,NaOH溶液,酚酞溶液等.
仪器:①________,②________,③________,试管夹,胶头滴管,镊子,小刀,玻璃片,砂纸,火柴等.
(3)实验内容:(填写与实验步骤对应的实验现象的编号和①②的化学方程式)
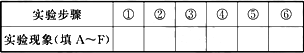
①________,②________.
(4)实验结论:________________.
(5)如何证明该周期剩余两种元素的非金属性强弱________________.