摘要:25.向某BaCl2溶液中逐滴加入某硫酸溶液.使其恰好完全反应.过滤.测得滤液的质量与原BaCl2溶液的质量相等.求该硫酸溶液中溶质的质量分数.
网址:http://m.1010jiajiao.com/timu3_id_162056[举报]
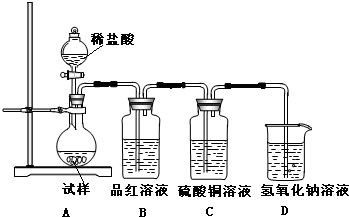 为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和图所示的实验装置进行实验.请回答下列有关问题:
为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和图所示的实验装置进行实验.请回答下列有关问题:(1)若某种固体物质受热发生了分解,下列说法正确的是
D
D
A.充分加热后一定有固体残留
B.加热前后固体颜色一定无变化
C.加热前后固体质量一定有变化
D.一定生成了新的物质
E.充分加热后得到的残留固体一定为混合物
(2)查阅资料:无水亚硫酸钠隔绝空气受热到600℃才开始分解,且分解产物只有硫化钠和另外一种固体.如果加热温度低于600℃,向所得固体试样中缓缓滴加稀盐酸至足量,在滴加稀盐酸的整个过程中HSO3-的物质的量浓度变化趋势为
先逐渐增大,后逐渐减小
先逐渐增大,后逐渐减小
;(3)如果加热温度为700℃,向所得固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,则固体试样跟盐酸反应生成淡黄色沉淀的离子方程式为
2S2-+SO32-+6H+=3S↓+3H2O
2S2-+SO32-+6H+=3S↓+3H2O
;此时在B、C两装置中可能观察到得现象为B中品红溶液褪色,C中无明显变化
B中品红溶液褪色,C中无明显变化
.(4)在(3)中滴加足量盐酸后,烧瓶内除Cl-外,还存在另一种浓度较大的阴离子(X).为检验该阴离子(X),先取固体试样溶于水配成溶液,为了加速固体试样的溶解,可采取
搅拌(或加热)
搅拌(或加热)
的措施.以下是检验阴离子(X)的两种实验方案,你认为合理的方案是乙
乙
(填“甲”或“乙”),请说明另一方案不合理的原因甲中先加入具有强氧化性的稀HNO3,它能将SO32-氧化成SO32-,不能判定是否生成SO32-
甲中先加入具有强氧化性的稀HNO3,它能将SO32-氧化成SO32-,不能判定是否生成SO32-
.方案甲:取少量试样溶液于试管中,先加稀HNO3,再加BaCl2溶液,有白色沉淀生成,证明该离子存在.
方案乙:取少量试样溶液于试管中,先加稀HCl,再加BaCl2溶液,有白色沉淀生成,证明该离子存在.
(5)写出Na2SO3固体加热到600℃以上分解的化学方程式
4Na2SO3
Na2S+3Na2SO4
| ||
4Na2SO3
Na2S+3Na2SO4
.
| ||
下述实验能达到预期目的是
| 实验内容 | 实验目的 | |
| A | 向盛有25ml沸水的烧杯中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸,至溶液呈红褐色 | 制备Fe(OH)3胶体 |
| B | 将SO2通入棕黄色溴水中,溶液褪色 | 证明SO2具有漂白性 |
| C | 淀粉溶液和稀硫酸混合加热后,加新制的Cu(OH)2悬浊液加热至沸腾 | 检验淀粉水解是否完全 |
| D | 向某无色溶液加入盐酸酸化的BaCl2溶液观察到有白色沉淀产生 | 检验溶液中是否存在SO42- |
- A.A
- B.B
- C.C
- D.D
下述实验能达到预期目的是( )
A.A
B.B
C.C
D.D
查看习题详情和答案>>
| 实验内容 | 实验目的 | |
| A | 向盛有25ml沸水的烧杯中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸,至溶液呈红褐色 | 制备Fe(OH)3胶体 |
| B | 将SO2通入棕黄色溴水中,溶液褪色 | 证明SO2具有漂白性 |
| C | 淀粉溶液和稀硫酸混合加热后,加新制的Cu(OH)2悬浊液加热至沸腾 | 检验淀粉水解是否完全 |
| D | 向某无色溶液加入盐酸酸化的BaCl2溶液观察到有白色沉淀产生 | 检验溶液中是否存在SO42- |
A.A
B.B
C.C
D.D
查看习题详情和答案>>
下述实验能达到预期目的是( )
|
查看习题详情和答案>>
(2013?北京)某学生对SO2与漂粉精的反应进行实验探究:
(1)Cl2和Ca(OH)2制取漂粉精的化学方程是
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是
(3)向水中持续通入SO2,未观察到白雾.推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀.
①实验a目的是
②由实验a、b不能判断白雾中含有HCl,理由是
(4)现象ⅱ中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应.通过进一步实验确认了这种可能性,其实验方案是
(5)将A瓶中混合物过滤、洗涤,得到沉淀X.
①向沉淀X中加入稀HCl,无明显变化.取上层清液,加入BaCl2溶液,产生白色沉淀.则沉淀X中含有的物质是
②用离子方程式解释现象ⅲ中黄绿色褪去的原因:
查看习题详情和答案>>
| 操作 | 现象 |
| 取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
 |
i.液面上方出现白雾; ⅱ.稍后,出现浑浊,溶液变为黄绿色; ⅲ.稍后,产生大量白色沉淀,黄绿色褪去 |
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
.(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是
碱性、漂白性
碱性、漂白性
.(3)向水中持续通入SO2,未观察到白雾.推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀.
①实验a目的是
检验白雾中是否含有Cl2,排除Cl2干扰
检验白雾中是否含有Cl2,排除Cl2干扰
.②由实验a、b不能判断白雾中含有HCl,理由是
白雾中混有SO2,SO2可与酸化的AgNO3反应产生白色沉淀
白雾中混有SO2,SO2可与酸化的AgNO3反应产生白色沉淀
.(4)现象ⅱ中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应.通过进一步实验确认了这种可能性,其实验方案是
向漂白精溶液中逐滴加入硫酸,观察溶液是否变为黄绿色
向漂白精溶液中逐滴加入硫酸,观察溶液是否变为黄绿色
.(5)将A瓶中混合物过滤、洗涤,得到沉淀X.
①向沉淀X中加入稀HCl,无明显变化.取上层清液,加入BaCl2溶液,产生白色沉淀.则沉淀X中含有的物质是
CaSO4
CaSO4
.②用离子方程式解释现象ⅲ中黄绿色褪去的原因:
SO2+Cl2+2H2O=SO42-+2Cl-+4H+
SO2+Cl2+2H2O=SO42-+2Cl-+4H+
.