摘要:4].根据反应:2H2S+O2=2S↓+2H2O.4NaI+O2+2H2SO4=2I2+2Na2SO4+2H2O.Na2S+I2=2NaI+S↓.判断下列物质的氧化性强弱.正确的是 ( ) A O2>I2>S B H2S>NaI>H2O C S>I2>O2 D H2O>NaI>H2S
网址:http://m.1010jiajiao.com/timu3_id_161873[举报]
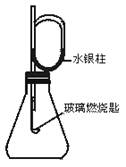
 如图装置,待内外空气压强不变时标注出水银液面的刻度(用红漆),取下橡皮塞,在玻璃燃烧匙中加入硫粉,用酒精灯点燃迅速移入锥形瓶中并塞紧橡皮塞.硫粉安静地燃烧,水银柱推向左管.当火焰熄灭后静置,水银柱又慢慢回到原先标定的刻度.简要回答下列问题:
如图装置,待内外空气压强不变时标注出水银液面的刻度(用红漆),取下橡皮塞,在玻璃燃烧匙中加入硫粉,用酒精灯点燃迅速移入锥形瓶中并塞紧橡皮塞.硫粉安静地燃烧,水银柱推向左管.当火焰熄灭后静置,水银柱又慢慢回到原先标定的刻度.简要回答下列问题:(1)水银柱推向左管说明了
该反应是放热反应;气体受热膨胀
该反应是放热反应;气体受热膨胀
.(2)硫粉未燃尽时火焰就熄灭了,说明
瓶内氧气耗尽
瓶内氧气耗尽
.(3)根据水银柱最后回到原先标定的刻度,可得到的结论是
同温、同压下,反应消耗的氧气与生成的SO2体积相同;压强相同;物质的量相同
同温、同压下,反应消耗的氧气与生成的SO2体积相同;压强相同;物质的量相同
.(4)根据反应方程式S+O2
| ||
同温、同压下,相同体积的气体含有相同的分子数
同温、同压下,相同体积的气体含有相同的分子数
.(1)①A图是“四种基本反应类型与氧化还原反应的关系”图,请在A图中用阴影部分表示反应:H2+CuO═Cu+H2O所属的区域是
 .
.
②“四种基本反应类型与氧化还原反应的关系”也可用B图表达.其中Ⅰ为化合反应,则Ⅱ为

(2)已知反应:①SO3+H2O═H2SO4
②Cl2+H2O═HCl+HClO
③2F2+2H2O═4HF+O2
④2Na+2H2O═2NaOH+H2↑
⑤2Na2O2+2H2O═4NaOH+O2↑
⑥SiO2+2NaOH═Na2SiO3+H2O
上述反应中不属于氧化还原反应的有
(3)反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,
Mn元素的化合价由
(4)根据反应①2FeCl3+2KI═2FeCl2+2KCl+I2,②2FeCl2+Cl2=2FeCl3,判断下列物质的氧化性由强到弱的顺序中,正确的是
A.Fe3+>Cl2>I2 B.Cl2>I2>Fe3+
C.I2>Cl2>Fe3+ D.Cl2>Fe3+>I2.
查看习题详情和答案>>


②“四种基本反应类型与氧化还原反应的关系”也可用B图表达.其中Ⅰ为化合反应,则Ⅱ为
分解
分解
反应.写出有水生成的符合反应类型Ⅲ的一个化学方程式:NaOH+HCl═NaCl+H2O
NaOH+HCl═NaCl+H2O
.写出有水参加的符合反应类型Ⅳ的一个化学方程式:2Na+2H2O═2NaOH+H2↑
2Na+2H2O═2NaOH+H2↑
,其中水为氧化
氧化
剂.
(2)已知反应:①SO3+H2O═H2SO4
②Cl2+H2O═HCl+HClO
③2F2+2H2O═4HF+O2
④2Na+2H2O═2NaOH+H2↑
⑤2Na2O2+2H2O═4NaOH+O2↑
⑥SiO2+2NaOH═Na2SiO3+H2O
上述反应中不属于氧化还原反应的有
①⑥
①⑥
(填序号,下同);H2O被氧化的是③
③
,H2O被还原的是④
④
,属于氧化还原反应,但其中的H2O既不被氧化,又不被还原的是②⑤
②⑤
.(3)反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,
Mn元素的化合价由
+7
+7
价变为+2
+2
价,被还原
还原
;Cl
Cl
元素的原子失去电子,被氧化
氧化
;若参加反应的HCl是73g,则被氧化的HCl是45.625
45.625
g.(4)根据反应①2FeCl3+2KI═2FeCl2+2KCl+I2,②2FeCl2+Cl2=2FeCl3,判断下列物质的氧化性由强到弱的顺序中,正确的是
D
D
A.Fe3+>Cl2>I2 B.Cl2>I2>Fe3+
C.I2>Cl2>Fe3+ D.Cl2>Fe3+>I2.
根据反应:2H2S+O2═2S↓+2H2O,4NaI+O2+2H2SO4═2I2+2Na2SO4+2H2O,Na2S+I2═2NaI+S↓下列物质的氧化性强弱判断正确的是( )
查看习题详情和答案>>
如右图所示,装配好装置,当内外空气压强不变时标出水银液面的刻度(用红漆),取下橡皮塞,在玻璃燃烧匙中加入硫粉,用酒精灯点燃,迅速移入锥形瓶中并塞紧橡皮塞,硫粉安静地燃烧,水银柱被推向右管,当火焰熄灭后静置,水银柱又慢慢回到原先标定的刻度。简要完成下列问题:
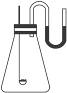
(1)水银柱推向右管说明了___________________。
(2)硫粉未燃尽时火焰就熄灭了,说明___________________。
(3)根据水银柱最后又回到原先标定的刻度,可得到的结论是___________________。
(4)根据反应方程式S+O2![]() SO2和上述结论又可推导出(或证明)___________________________________________________________。
SO2和上述结论又可推导出(或证明)___________________________________________________________。