摘要:.27.实验可用高锰酸钾与浓盐酸反应制氯气.该反应的化学方程式为:2KMnO4+16HCl==2KCl+2MnCl2+5Cl2↑+8H2O .①将7.9 g高锰酸钾与50 mL12 mol/L盐酸反应可制得多少升氯气?②若往反应后的溶液中加入足量的硝酸银溶液.可生成多少克氯化银沉淀? 高一第一学期化学期末考试答卷卡
网址:http://m.1010jiajiao.com/timu3_id_161666[举报]
氯气是一种重要的化工原料,在生产和生活中应用十分广泛.已知:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,所以在实验室可用高锰酸钾固体和浓盐酸制氯气.
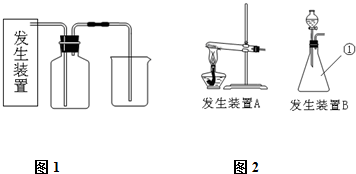
(1)请为该实验选择合适的发生装置 (填A或B).
(2)处理尾气时,发生反应的化学方程式: .
(3)用双线桥法标出2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O反应中电子转移的方向和数目.
(4)在该反应中,氧化剂是 ,氧化产物是 .
(5)若生成标准状况下11.2L 氯气,则转移电子 mol,被氧化的HCl为 mol.
查看习题详情和答案>>

(1)请为该实验选择合适的发生装置
(2)处理尾气时,发生反应的化学方程式:
(3)用双线桥法标出2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O反应中电子转移的方向和数目.
(4)在该反应中,氧化剂是
(5)若生成标准状况下11.2L 氯气,则转移电子
如图是某同学设计的制备少量氯气并进行系列实验的装置(夹持及加热仪器已略).
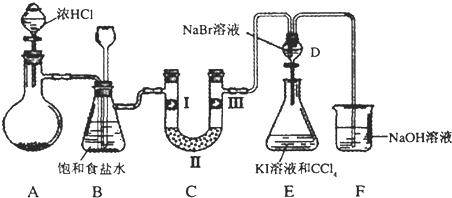
(1)若装置A中制备氯气选用的药品为固体二氧化锰和浓盐酸,请写出装置A中的化学反应方程式: ;实验室也可用高锰酸钾制氯气:2KMnO4+16HCl(浓)=5Cl2↑+2MnCl2+2KCl+8H2O该反应中的氧化剂是 ,若消耗0.2mol氧化剂,则被氧化的还原剂的物质的量是 mol;
(2)装置B中饱和食盐水的作用是 ;
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入 ;
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱.当向D中缓缓通入少量氯气时,可以看到D中无色溶液逐渐变为 色,若打开D装置的活塞,使D中溶液滴入E装置,振荡锥形瓶后静置一会儿,可以观察到的现象是 ;
(5)装置F中用足量的NaOH溶液吸收余氯,试写出相应的离子方程式 .
查看习题详情和答案>>

(1)若装置A中制备氯气选用的药品为固体二氧化锰和浓盐酸,请写出装置A中的化学反应方程式:
(2)装置B中饱和食盐水的作用是
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入
| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 硅胶 | 碱石灰 | 无水氯化钙 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(5)装置F中用足量的NaOH溶液吸收余氯,试写出相应的离子方程式
氯气是一种重要的化工原料,在生产和生活实际中应用十分广泛.
已知:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,所以在实验室可用高锰酸钾固体和浓盐酸制氯气.
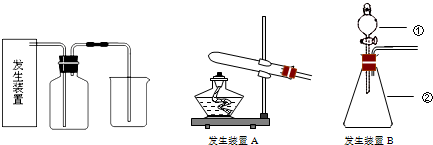
(1)请为该实验选择合适的发生装置 .(填“A”或“B”)
(2)在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O反应中,氧化剂是 .
(3)当集气瓶中收集满氯气时,可以观察到气体呈 色.
(4)工业上常用电解饱和食盐水制取氯气,试完成该反应的化学方程式:
2NaCl+2H2O
2NaOH+ +Cl2↑
(5)写出仪器名称:① ,② .
查看习题详情和答案>>
已知:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,所以在实验室可用高锰酸钾固体和浓盐酸制氯气.

(1)请为该实验选择合适的发生装置
(2)在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O反应中,氧化剂是
(3)当集气瓶中收集满氯气时,可以观察到气体呈
(4)工业上常用电解饱和食盐水制取氯气,试完成该反应的化学方程式:
2NaCl+2H2O
| ||
(5)写出仪器名称:①
氯气是一种重要的化工原料,在生产和生活中应用十分广泛.已知:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,所以在实验室可用高锰酸钾固体和浓盐酸制氯气.
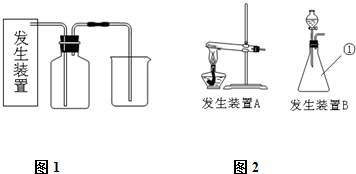
(1)请为该实验选择合适的发生装置______(填A或B).
(2)处理尾气时,发生反应的化学方程式:______.
(3)用双线桥法标出2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O反应中电子转移的方向和数目.
(4)在该反应中,氧化剂是______,氧化产物是______.
(5)若生成标准状况下11.2L 氯气,则转移电子______mol,被氧化的HCl为______ mol.
查看习题详情和答案>>
氯气是一种重要的化工原料,在生产和生活中应用十分广泛.
已知:2KMnO4+16HCl(浓)![]() 2KCl+2MnCl2+5Cl2↑+8H2O,所以在实验室可用高锰酸钾固体和浓盐酸制氯气.
2KCl+2MnCl2+5Cl2↑+8H2O,所以在实验室可用高锰酸钾固体和浓盐酸制氯气.
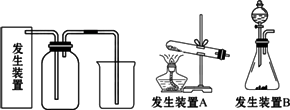
(1)请为该实验选择合适的发生装置________.(填“A”或“B”)
(2)在2KMnO4+16HCl(浓)![]() 2KCl+2MnCl2+5Cl2↑+8H2O反应中,氧化剂是________.
2KCl+2MnCl2+5Cl2↑+8H2O反应中,氧化剂是________.
(3)当集气瓶中收集满氯气时,可以观察到气体呈________色.烧杯中所盛液体为________,其作用是________________.
(4)工业上常用电解饱和食盐水制取氯气,试写出该反应的化学方程式:________.