摘要:解:反应后隔板处于正中央.左右压强相等.则两边气体物质的量相等.依题意.设起始时左侧中N2为1 mol.则右侧中H2.O2共3 mol.反应后右侧剩余气体1mol.反应中消耗H2.O2共2mol 根据反应式 2H2 + O22H2O 反应消耗的H2为 ×2 mol = mol O2为×2mol = mol (1)若剩余气体为H2.则起始时H2的物质的量为: n(H2)=mol + 1mol=mol 则原混合气中V(H2):V(O2)=7:2 (2)若剩余气体为O2.则起始时O2的物质的量为: n(O2)=mol +1mol =mol 则原混合气中V(H2):V(O2)=4:5 答:反应前H2和O2的体积比为7:2或4:5
网址:http://m.1010jiajiao.com/timu3_id_161469[举报]
图为一带可移动隔板的密闭容器,某温度下,左、右两侧反应均达平衡,此时隔板处于容器中央。若保持温度不变,向左侧容器中充入一定量的H2,下列说法正确的是 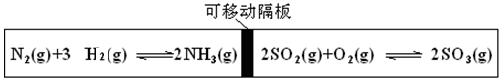
| A.两侧平衡均向正反应方向移动 | B.左侧平衡向逆反应方向移动 |
| C.右侧平衡向逆反应方向移动 | D.两侧平衡均向逆反应方向移动 |
图为一带可移动隔板的密闭容器,某温度下,左、右两侧反应均达平衡,此时隔板处于容器中央。若保持温度不变,向左侧容器中充入一定量的H2,下列说法正确的是
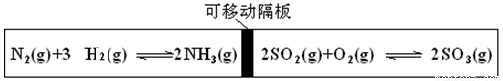
A.两侧平衡均向正反应方向移动 B.左侧平衡向逆反应方向移动
C.右侧平衡向逆反应方向移动 D.两侧平衡均向逆反应方向移动
查看习题详情和答案>>
图为一带可移动隔板的密闭容器,某温度下,左、右两侧反应均达平衡,此时隔板处于容器中央。若保持温度不变,向左侧容器中充入一定量的H2,下列说法正确的是
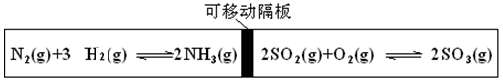
- A.两侧平衡均向正反应方向移动
- B.左侧平衡向逆反应方向移动
- C.右侧平衡向逆反应方向移动
- D.两侧平衡均向逆反应方向移动

 2c(g) ΔH1<0、 乙: x(g)+3y(g)
2c(g) ΔH1<0、 乙: x(g)+3y(g)