网址:http://m.1010jiajiao.com/timu3_id_161266[举报]
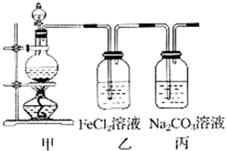 (2013?滨州一模)(1)某学习小组利用下图装置制取氯气并探究其性质.
(2013?滨州一模)(1)某学习小组利用下图装置制取氯气并探究其性质.①甲装置中反应的化学方程式是
| ||
| ||
②证明乙装置中FeCl2溶液与Cl2发生了反应的实验方法是(只注明试剂、现象)
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质.已知碳酸的酸性强于次氯酸,则丙中反应的化学方程式是
(2)有一瓶长期放置的漂白粉,请利用以下仪器和试剂,完成该漂白粉成份的探究.
试管、胶头滴管、带导管的单孔塞、蒸馏水、1mol?L-1盐酸、品红溶液、新制澄清石灰水.
【提出假设】假设一:该漂白粉未变质,含CaCl2、Ca(ClO)2;
假设二:该漂白粉全部变质,含
假设三:该漂白粉部分变质,含CaCl2、Ca(ClO)2、CaCO3.
【进行实验】在答题卡上完成下表(不必检验Ca2+、Cl-):
| 实验步骤 | 预期现象和结论 | |
| ① | 用A试管取少量澄清石灰水备用,用B试管取少量样品,再向B试管 加入适量1mol/L的盐酸,塞上带导管的单孔塞,将导管的另一端插入A试管中 加入适量1mol/L的盐酸,塞上带导管的单孔塞,将导管的另一端插入A试管中 |
若无气体放出且澄清石灰水未见浑浊,则假设一成立; 若有气泡冒出,且澄清石灰水变浑浊则假设一步成立,假设二、三成立 若有气泡冒出,且澄清石灰水变浑浊则假设一步成立,假设二、三成立 |
| ② | 用胶头滴管向上述步骤后的B试管中滴入几滴品红试液,振荡 用胶头滴管向上述步骤后的B试管中滴入几滴品红试液,振荡 |
若品红溶液不褪色,则假设二成立,若品红溶液褪色,则假设三成立 若品红溶液不褪色,则假设二成立,若品红溶液褪色,则假设三成立 |
 (2011?惠州模拟)铁、铜都是人类最早使用的金属,它们的单质及化合物应用非常广泛.
(2011?惠州模拟)铁、铜都是人类最早使用的金属,它们的单质及化合物应用非常广泛.(1)钢铁“发蓝,,是将钢铁制品浸到某些氧化性溶液中,使其表面形成一层四氧化三铁的过程.其中有一种办法是将钢铁制品浸到亚硝酸钠和浓氢氧化钠的混合溶液中加热至1300C,反应过程为:
I.3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
II.6Na2FeO2+NaNO2+5H2O=3Na2Fe2O4+NH3↑十+7NaOH
Ⅲ.Na2FeO2+Na2Fe2O4+2H2O=Fe3O4+4NaOH
①反应II中的氧化剂是
②上述过程产生了大量NH3,有关NH3处理方案合理的是
a.用H2SO4吸收制氮肥 b. 高空排放 C.用于制备HNO3
(2)工业上常用氯化铁溶液腐蚀铜制电路板.
①请根据金属活动顺序及反应原理,判断Cu2+、Fe3+、Fe2+的氧化性强弱顺序:
②请设计实验验证Cu2+、Fe3+氧化性强弱的结论.实验方案及现象为:
(3)如图横坐标为溶液pH,纵坐标为金属离子物质的量浓度的对数值(当溶液中金属离子浓度≤10-5 mol?L-1时,可认为沉淀完全),试回答:
①腐蚀铜板后的溶液中,若Cu2+、Fe3+和Fe2+浓度均为0.1mol?L-1,今向混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金属阳离子为
②从图中数据计算可得Fe(OH)2的溶度积Ksp[Fe(OH)2]=
某种橡胶分解产物为碳氢化合物,对这种碳氢化合物作如下实验:①若取一定量完全燃烧,使燃烧后的气体通过盛有氯化钙的干燥管,干燥管增重0.72g,再通过石灰水,石灰水增重2.2g。②经测定,该碳氢化合物(气体)的密度是相同条件下氢气密度的34倍。③该碳氢化合物0.1mol能和32g溴起加成反应.④经分析,在③的生成物中,溴原子分布在不同的碳原子上,且溴代物中有一个碳原子在支链上。下列说法正确的是
| A.该碳氢化合物为2-甲基-1,3-戊二烯 |
| B.该碳氢化合物与溴单质1:1加成时可以生成3种不同的产物 |
| C.该碳氢化合物与溴单质1:1加成时可以生成2种不同的产物 |
| D.该碳氢化合物与足量氢气加成时可以生成正戊烷 |
| A.该碳氢化合物为2-甲基-1,3-戊二烯 |
| B.该碳氢化合物与溴单质1:1加成时可以生成3种不同的产物 |
| C.该碳氢化合物与溴单质1:1加成时可以生成2种不同的产物 |
| D.该碳氢化合物与足量氢气加成时可以生成正戊烷 |
电子产品产生的大量电子垃圾对环境构成了极大的威胁。某化学兴趣小组将一批废弃的线路板简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:

按要求回答下列问题:
(1)滤渣1中存在的金属有_____________。
(2)已知沉淀物的pH如下表:
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe2+ |
7.0 |
9.0 |
|
Fe3+ |
1.9 |
3.7 |
|
Cu2+ |
4.9 |
6.7 |
|
Al3+ |
3.0 |
4.4 |
①则操作②中X物质最好选用的是___________(填编号)
a.酸性高锰酸钾溶液 b.漂白粉 c.氯气 d.双氧水
②理论上应控制溶液pH的范围是________________________。
(3)检验滤液2中既不存在Fe2+又不存在Fe3+的操作步骤是____________________。
(4)用一个离子方程式表示在酸浸液中加入适量铝粉的反应:___________________。
(5)由CuSO4·5H2O制备CuSO4时,应把CuSO4·5H2O放在______(填仪器名称)中加热脱水。
(6)现在某些电器中使用的高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为 3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2
+ 2Fe(OH)3 + 4KOH,该电池放电时负极反应式为_______,每有1mol K2FeO4被还原,转移电子的物质的量为____,充电时阳极反应式为___________。
3Zn(OH)2
+ 2Fe(OH)3 + 4KOH,该电池放电时负极反应式为_______,每有1mol K2FeO4被还原,转移电子的物质的量为____,充电时阳极反应式为___________。
查看习题详情和答案>>