摘要: A为N.B为O.C为S
网址:http://m.1010jiajiao.com/timu3_id_161173[举报]
A、B、C均为短周期主族元素,它们在周期表中的位置如图所示。已知B、C两元素的原子序数之和为A元素的原子序数的4倍,则A、B、C依次为

[ ]
A.C、Al、P
B.N、Si、S
C.O、P、Cl
D.F、S、Ar
查看习题详情和答案>>
B.N、Si、S
C.O、P、Cl
D.F、S、Ar
(12分)⑴第ⅢA、ⅤA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。Ga原子的电子排布式为 ▲ 。在GaN晶体中,与同一个Ga原子相连的N原子构成的空间构型为 ▲ 。在四大晶体类型中,GaN属于 ▲ 晶体。
⑵K^S*5U.C#O%铜、铁元素能形成多种配合物。微粒间形成配位键的条件是:一方是能够提供孤电子对的原子或离子,另一方是具有 ▲ 的原子或离子
⑶CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:请回答下列问题: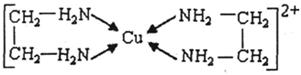
① H、N、O三种元素的电负性由大到小的顺序是 ▲ 。
②SO2分子的空间构型为 ▲ 。与SnCl4互为等电子体的一种离子的化学式为 ▲
③乙二胺分子中氮原子轨道的杂化类型为 ▲ 。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是 ▲ 。
④⑶中所形成的配离子中含有的化学键类型有 ▲ 。
a.配位键 b.极性键 c.离子键 d.非极性键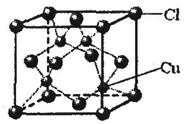
⑤CuCl的晶胞结构如上图所示,其中Cl原子的配位数为 ▲ 。
(14分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:K^S*5U.C#O
| 族 周期 | IA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | ⑦ | | | ⑧ | |
(1)④、⑤、⑥的原子半径由大到小的顺序为_________________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_________________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________

(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为_____________________,
N→⑥的单质的化学方程式为________________。K^S*5U.C#O
常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至_________________。 查看习题详情和答案>>
下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
| 族 周期 | IA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | | ⑨ | ⑦ | ⑧ | |
Ⅰ、(1)元素⑦中质子数和中子数相等的原子符号是________________。
(2)④、⑤两种元素原子按1:1组成的常见化合物的化学式________________。
(3)③、⑧和⑨的最高价氧化物对应水化物的酸性由强到弱的顺序是________________。
(4)用电子式表示①和⑤形成化合物的过程_________________________。
Ⅱ、由表中元素形成的物质A、B、C可发生以下反应(副产物已略去),试回答:

(1)若X是强氧化性单质,则A不可能是______________
a、S b、N2 c、Na d、Mg e、Al
(2)若X是一种常见过渡金属单质,向C的水溶液中滴加硝酸银溶液,产生不溶于稀硝酸的白色沉淀,检验此C溶液中金属离子的方法是____________________________________
__________________________;又知在酸性溶液中该金属离子能被双氧水氧化,写出该反应的离子方程式:___________________________________________。 查看习题详情和答案>>