摘要:3.分别有Vml 1mol/L AgNO3溶液.恰好与相同体积的下述溶液完全反应.则这些溶液中物质的量浓度最大的是( ) A.KCl B.MgCl2 C.FeCl3 D.AlCl3
网址:http://m.1010jiajiao.com/timu3_id_160722[举报]
在下列事实中,各是什么因素影响了化学反应速率.
(1)集气瓶中H2和Cl2的混合气体,在瓶外点燃镁条时发生爆炸:
(2)黄铁矿煅烧时要粉碎成矿粒:
(3)熔化的KClO3放出气泡很慢,撒入少量MnO2则很快产生气体:
(4)同浓度、同体积的盐酸放入同样大小的锌粒和镁条,产生气体有快有慢:
(5)同样大小的石灰石分别与0.1mol?L-1盐酸和1mol?L-1盐酸反应,速率不同:
(6)夏天食品容易变质,而冬天不易发生该现象:
查看习题详情和答案>>
(1)集气瓶中H2和Cl2的混合气体,在瓶外点燃镁条时发生爆炸:
光照
光照
.(2)黄铁矿煅烧时要粉碎成矿粒:
固体表面积
固体表面积
.(3)熔化的KClO3放出气泡很慢,撒入少量MnO2则很快产生气体:
催化剂
催化剂
.(4)同浓度、同体积的盐酸放入同样大小的锌粒和镁条,产生气体有快有慢:
反应物本身的性质
反应物本身的性质
.(5)同样大小的石灰石分别与0.1mol?L-1盐酸和1mol?L-1盐酸反应,速率不同:
浓度
浓度
.(6)夏天食品容易变质,而冬天不易发生该现象:
温度
温度
.(2011?晋中三模)请回答下列问题:
(1)现代工业将煤炭气化,既可以提高燃料的利用率、减少CO、SO2等的排放,又可以扩大水煤气的广泛用途.
①已知:2C(s)+O2(g)=2CO(g);△H1,2H2(g)+O2(g)=2H2O(g);△H2.
则反应C(s)+H2O(g)?CO(g)+H2(g);△H=
.(用含△H1、△H2的代数式表示)
②CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)?CH3OH(g);△H3.现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验,测得相关数据如下图1和图2.
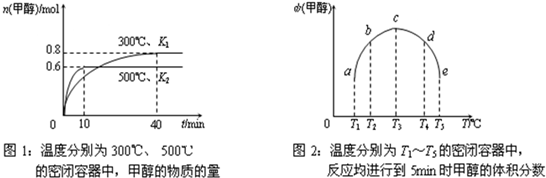
a.该反应的△H3
b.将容器d中的平衡状态转变到容器c中的平衡状态,可采取的措施有
(2)某燃料电池以熔融态K2CO3为电解质,一极通入CO,另一极通入空气和CO2的混合气体.已知该燃料电池正极反应为2CO2+O2+4e-=2CO32-;则其负极的电极反应式为
(3)图3为某温度下,Fe(OH)3(s)、Mg(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度变化情况.据图分析:
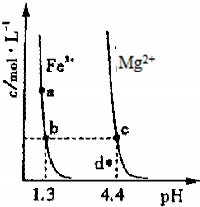
该温度下,溶度积常数的关系为:Ksp[Fe(OH)3]
(填:>、=、<);如果在新生成的Mg(OH)2浊液中滴入足量的Fe3+,振荡后,白色沉淀会全部转化为红褐色沉淀,原因是
查看习题详情和答案>>
(1)现代工业将煤炭气化,既可以提高燃料的利用率、减少CO、SO2等的排放,又可以扩大水煤气的广泛用途.
①已知:2C(s)+O2(g)=2CO(g);△H1,2H2(g)+O2(g)=2H2O(g);△H2.
则反应C(s)+H2O(g)?CO(g)+H2(g);△H=
| △H1-△H 2 |
| 2 |
| △H1-△H 2 |
| 2 |
②CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)?CH3OH(g);△H3.现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验,测得相关数据如下图1和图2.

a.该反应的△H3
<
<
0(选填“<”、“>”或“=”,下同),K1>
>
K2.b.将容器d中的平衡状态转变到容器c中的平衡状态,可采取的措施有
升温、减压
升温、减压
.(2)某燃料电池以熔融态K2CO3为电解质,一极通入CO,另一极通入空气和CO2的混合气体.已知该燃料电池正极反应为2CO2+O2+4e-=2CO32-;则其负极的电极反应式为
CO+CO32--2e-=2CO2
CO+CO32--2e-=2CO2
.(3)图3为某温度下,Fe(OH)3(s)、Mg(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度变化情况.据图分析:

该温度下,溶度积常数的关系为:Ksp[Fe(OH)3]
<
<
Ksp[Mg(OH)2](填:>、=、<);如果在新生成的Mg(OH)2浊液中滴入足量的Fe3+,振荡后,白色沉淀会全部转化为红褐色沉淀,原因是
由于Ksp[Fe(OH)3]<Ksp[Mg(OH)2],浊液中存在溶解平衡:Mg(OH)2?Mg2++2OH-,当加入Fe3+后与OH-生成更难溶解的Fe(OH)3,使平衡继续向右移动,最后Mg(OH)2全部溶解转化为红棕色的Fe(OH)3.
由于Ksp[Fe(OH)3]<Ksp[Mg(OH)2],浊液中存在溶解平衡:Mg(OH)2?Mg2++2OH-,当加入Fe3+后与OH-生成更难溶解的Fe(OH)3,使平衡继续向右移动,最后Mg(OH)2全部溶解转化为红棕色的Fe(OH)3.
.(双选).在密闭容器中进行反应X2(g)+Y2(g)?2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol.L-1、0.3mol.L-1、0.2mol.L-1,在一定条件下当反应达到平衡时,各物质的浓度有可能是( )
| A、Z为0.3mol.L-1, | B、X2为0.2mol.L-1, | C、Y2为0.3mol.L-1, | D、Z为0.4mol.L-1, |
(1)有下列各组微粒或物质:①CH4和C3H8 ②CH3CH(CH3)2和CH3CH2CH2CH3 ③12C和14C
④
以上各微粒或物质中互为同位素的是
(2)影响化学反应速率的因素很多,在下列事实中什么因素影响了化学反应速率:
①黄铁矿煅烧时要粉碎成矿粒:
②熔化的KClO3放出气泡很慢,撒入少量MnO2很快产生气体:
③夏天的食品易霉变,而冬天不易发生该现象:
④同样大小的石灰石分别在0.1mol/L的盐酸和1.0mol/L的盐酸中反应速率不同:
查看习题详情和答案>>
④

以上各微粒或物质中互为同位素的是
③
③
;互为同分异构体的是②
②
; 互为同系物的是①
①
;属于同一种物质的是④
④
.(用序号填写)(2)影响化学反应速率的因素很多,在下列事实中什么因素影响了化学反应速率:
①黄铁矿煅烧时要粉碎成矿粒:
固体表面积
固体表面积
;②熔化的KClO3放出气泡很慢,撒入少量MnO2很快产生气体:
催化剂
催化剂
;③夏天的食品易霉变,而冬天不易发生该现象:
温度
温度
;④同样大小的石灰石分别在0.1mol/L的盐酸和1.0mol/L的盐酸中反应速率不同:
浓度
浓度
.