摘要:29.现有K2SO4和H2SO4的混合溶液100 mL.其中K2SO4的物质的量浓度为0.5 mol/L.H2SO4的物质的量浓度为1 mol/L.现要求将上述混合溶液中K2SO4的浓度改变为0.2 mol/L.H2SO4的浓度改变为2 mol/L.应加入98%(密度是1.84 g/cm3)的硫酸多少毫升?
网址:http://m.1010jiajiao.com/timu3_id_160632[举报]
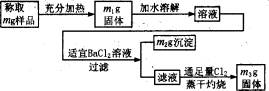
实验室需要一些纯净的KCl,而现有的氯化钾含有少量的KI、K2SO4和NH4Cl。
请完成提纯实验操作方案和回答有关问题。
序号 | 实验步骤 | 简述实验操作(不叙述如何组装实验装置) | 问题 |
① | 加水溶解 | 将固体混合物放入烧杯中,加入适量的水,充分搅拌直至固体全部溶解 |
|
② | 沉淀 | 向上述①溶液中,加入适量的________溶液,搅拌,直到沉淀不再生成 | 如何检验沉淀是否完全:____________ |
③ | 过滤 | 安装好过滤装置,将②的悬浊液沿玻璃棒加入过滤器中过滤 | 过滤中,发现滤液浑浊,原因是____________ |
④ | 除去I- | _________ | 实验现象:_________ |
⑤ | 蒸干、灼热 | 蒸发、浓缩后将溶液转入________表面皿中继续加热蒸干,再转入中灼烧。得到纯净的KCl固体 | 灼烧的目的是:_________ |
实验室需要一些纯净的氯化钾,而现有氯化钾中含有少量KI、K2SO4和NH4Cl。现按照以下方案提纯氯化钾,并计算不纯氯化钾样品中各组分的质量分数:

(1)给样品加热时,发生反应的化学方程式为________,应在________(仪器)中加热。
(2)过滤操作使用的仪器有________。
(3)通入足量Cl2并蒸干灼烧的目的是________。
查看习题详情和答案>>