网址:http://m.1010jiajiao.com/timu3_id_160143[举报]
①将1L pH=3的A溶液分别与0.001mol/L x L B溶液、0.001mol/L y L D溶液充分反应至中性,x、y的大小关系式y<x;
②浓度均为0.1mol/L A和E溶液,pH:A<E
③浓度均为0.1mol/L C和D溶液等体积混合,溶液呈酸性.
回答下列问题:
(1)C是
(2)用水稀释0.1mol/L B溶液时,溶液中随水量的增加而减小的是
A.
| c(B) |
| c(OH-) |
| c(OH-) |
| c(H+) |
(3)等pH、等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出的氢气的质量相同.则
(4)常温下,向0.01mol/L C溶液中滴加0.01mol/L D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为
(5)已知常温下Mg(OH)2在pH=12的D溶液中Mg2+的浓度为1.8×10-7mol/L,则 Ksp[Mg(OH)2]=
(16分)利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。
Ⅰ.染料工业排放的废水中含有大量有毒的NO2¯,可以在碱性条件下加入铝粉除去(加热处理后的废水,会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO2-的离子方程式为 。
Ⅱ.某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+):

部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
|
阳离子 |
Fe3+ |
Fe2+ |
Mg2+ |
Al3+ |
Cu2+ |
Cr3+ |
|
开始沉淀时的pH |
1.9 |
7.0 |
—— |
—— |
4.7 |
—— |
|
沉淀完全时的pH |
3.2 |
9.0 |
11.1 |
8 |
6.7 |
9 (>9溶解) |
(1)实验室用18.4 mol·L-1的浓硫酸配制250 mL 4.8 mol·L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需 。
(2)加入H2O2的作用是 。
(3)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的杂质离子是
(选填:Fe3+、Al3+、Ca2+、Mg2+)。
Ⅲ.印刷电路铜板腐蚀剂常用FeCl3。腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤① ② ③过滤。(提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu)
查看习题详情和答案>>
利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺如下:
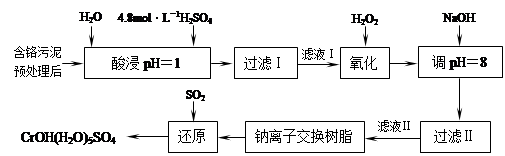
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4 mol·L―1的浓硫酸配制250 mL 4.8 mol·L―1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和胶头滴管外,还需 。
(2)酸浸时,为了提高浸取率可采取的措施有 、
。(写出两个措施)
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72―,写出此反应的离子方程式:
。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | —— | —— | —— |
| 沉淀完全时的pH | 3.7 | 11.1 | 8 | 9(>9溶解) |
加入NaOH溶液使溶液呈碱性,Cr2O72―转化为CrO42―。滤液Ⅱ中阳离子主要有 ;但溶液的pH不能超过8,其理由是 。
(5)钠离子交换树脂的反应原理为:Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是 。
(6)写出上述流程中用SO2进行还原的化学方程式 。
查看习题详情和答案>>