摘要:解:(1)最终溶质为NaCl NaOH- HCl - NaCl - Na
网址:http://m.1010jiajiao.com/timu3_id_159994[举报]
工业上制氯化铜无水物时,是将浓盐酸用蒸气加热至80℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁和SiO2),充分搅拌后使之溶解,制取流程如下:
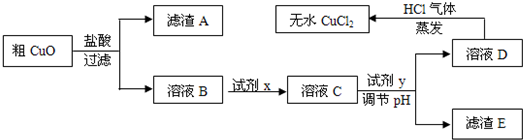
已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;常温时Ksp[Fe(OH)3]=c(Fe3+).c3(OH-)=1.0×10-38.试回答:
(1)根据常温时Fe(OH)3的Ksp计算,当溶液中的Fe3+完全沉淀(此时溶液中的Fe3+物质的量的浓度=10-5mol/L),溶液的pH=
(2)溶液D制取无水CuCl2时,需在HCl气体中蒸干,原因是
(3)粗CuO溶于过量盐酸后,得到的溶液B中加入试剂x将Fe2+氧化为Fe3+,试剂x可以是
A.KMnO4溶液 B.氯水 C.NaClO溶液 D.O3
若用H2O2溶液,则反应的离子方程式为
(4)溶液C加入试剂y,要调整溶液的pH至3-4,试剂y不能是
A.NaOH溶液 B.Cu(OH)2固体 C.Cu2(OH)2CO3固体 D.CuO固体
(5)将ag粗CuO经过以上一系列操作之后,最终得到bg无水CuCl2(不考虑实验过程中操作引起的损耗),下列说法正确的是
A.粗CuO中Cu2+数目小于
B.粗CuO中CuO物质的量小于
mol
C.粗CuO中所含的铜元素的质量分数为
x100%
D.粗CuO中关于CuO的量无法确定.
查看习题详情和答案>>

已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;常温时Ksp[Fe(OH)3]=c(Fe3+).c3(OH-)=1.0×10-38.试回答:
(1)根据常温时Fe(OH)3的Ksp计算,当溶液中的Fe3+完全沉淀(此时溶液中的Fe3+物质的量的浓度=10-5mol/L),溶液的pH=
3
3
.(2)溶液D制取无水CuCl2时,需在HCl气体中蒸干,原因是
HCl抑制CuCl2水解
HCl抑制CuCl2水解
.(3)粗CuO溶于过量盐酸后,得到的溶液B中加入试剂x将Fe2+氧化为Fe3+,试剂x可以是
BD
BD
(填以下选项序号).A.KMnO4溶液 B.氯水 C.NaClO溶液 D.O3
若用H2O2溶液,则反应的离子方程式为
2Fe2++H2O2+2H+=2Fe3++2H2O
2Fe2++H2O2+2H+=2Fe3++2H2O
.(4)溶液C加入试剂y,要调整溶液的pH至3-4,试剂y不能是
A
A
(填以下选项序号),原因是将引入新杂质NaCl
将引入新杂质NaCl
.A.NaOH溶液 B.Cu(OH)2固体 C.Cu2(OH)2CO3固体 D.CuO固体
(5)将ag粗CuO经过以上一系列操作之后,最终得到bg无水CuCl2(不考虑实验过程中操作引起的损耗),下列说法正确的是
ABD
ABD
.(NA表示阿伏伽德罗常数)A.粗CuO中Cu2+数目小于
| aNA |
| 80 |
| b |
| 135 |
C.粗CuO中所含的铜元素的质量分数为
| 64b |
| 135a |
D.粗CuO中关于CuO的量无法确定.