摘要:17.50mL18.0mol/L硫酸溶液中加入足量的铜片并加热.被还原的硫酸的物质的量 A.等于0.45mol B.小于0.45mol ( ) C.大于0.45mol.小于0.9mol D.等于0.9mol
网址:http://m.1010jiajiao.com/timu3_id_159261[举报]
由Al、CuO、Fe2O3组成的混合物共10.0g,放入500mL某浓度盐酸溶液中,混合物完全溶解,当再加入250mL 2.0mol/L的NaOH溶液时,得到的沉淀最多.该盐酸的浓度为( )
查看习题详情和答案>>
有下列溶液:
①0.5mol?L-1的NaOH溶液和1.0mol?L-1 HCl溶液等体积混合后的溶液
②pH=0的溶液
③c(OH-)=10-11 mol?L-1的溶液
④0.1mol?L-1 CH3COOH溶液,
它们的酸性由强到弱的顺序是( )
①0.5mol?L-1的NaOH溶液和1.0mol?L-1 HCl溶液等体积混合后的溶液
②pH=0的溶液
③c(OH-)=10-11 mol?L-1的溶液
④0.1mol?L-1 CH3COOH溶液,
它们的酸性由强到弱的顺序是( )
查看习题详情和答案>>
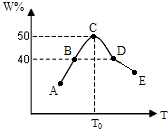 将5份物质的量均为2.0mol的X、Y混合,分别加入温度不同、容积相同(均为2L)的恒容容器中发生反应2X(g)+Y(g)?3W(g).经过相同时间10s时,五个容器中W的体积百分含量(W%)随温度(T)变化的关系如图.
将5份物质的量均为2.0mol的X、Y混合,分别加入温度不同、容积相同(均为2L)的恒容容器中发生反应2X(g)+Y(g)?3W(g).经过相同时间10s时,五个容器中W的体积百分含量(W%)随温度(T)变化的关系如图.(1)前10sB容器中的平均反应速率v(Y)=
2.7×10-2mol/L?s
2.7×10-2mol/L?s
;此反应的正反应为放
放
热反应;(2)10s时A容器中v正
>
>
v逆(填=、>或<,下同);B、D两容器中正反应速率关系vB<
<
vD.(3)若10s时C点生成物W的体积分数为50.0%,则X的转化率为
66.7%
66.7%
.(4)若10s时保持E容器的温度与体积不变,向E容器中中通入0.6molW,要求重新达到平衡时混合物中各组分的百分含量不变,则此时还需同时通入
0.2
0.2
mol反应物Y.(1)用18mol/L浓硫酸配制100mL 1.0mol/L的稀硫酸,若实验仪器有:
A.100mL量筒 B.玻璃棒 C.托盘天平 D.50mL容量瓶
E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
实验时必须选用的仪器是(填入字母)
(2)在配制过程中,下列操作不正确的是
A.使用容量瓶前需检查它是否漏水
B.容量瓶用蒸馏水洗净后,一定要干燥后再使用
C.配制溶液时,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水至刻度线
D.定容后盖好瓶塞,反复上下颠倒,摇匀
(3)若实验时遇到下列情况,将使所配溶液的浓度 (填“偏高”、“偏低”或“无影响”)
A.定容时俯视读数
C.洗涤量筒,并将洗涤液转入容量瓶
查看习题详情和答案>>
A.100mL量筒 B.玻璃棒 C.托盘天平 D.50mL容量瓶
E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
实验时必须选用的仪器是(填入字母)
BEFGH
BEFGH
(2)在配制过程中,下列操作不正确的是
BC
BC
A.使用容量瓶前需检查它是否漏水
B.容量瓶用蒸馏水洗净后,一定要干燥后再使用
C.配制溶液时,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水至刻度线
D.定容后盖好瓶塞,反复上下颠倒,摇匀
(3)若实验时遇到下列情况,将使所配溶液的浓度 (填“偏高”、“偏低”或“无影响”)
A.定容时俯视读数
偏高
偏高
B.未将洗涤液转入容量瓶偏低
偏低
C.洗涤量筒,并将洗涤液转入容量瓶
偏高
偏高
.