网址:http://m.1010jiajiao.com/timu3_id_158554[举报]
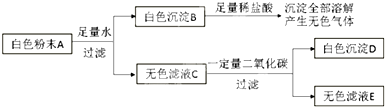
(1)取白色粉末A,向其中加入足量水,充分搅拌后过滤,得到白色沉淀B和无色滤液C,由此可判断,原白色粉末中一定不含有
(2)向白色沉淀B中加入足量稀盐酸,沉淀全部溶解,并产生无色气体.由此可判断,原白色粉末中一定含有
(3)向无色滤液C中通入一定量二氧化碳,充分反应后过滤,得到白色沉淀D和无色滤液E,由此可判断,原白色粉末中一定还含有
(4)若流程图中无色滤液E中只含一种溶质,则无色滤液E中的溶质为
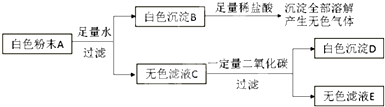
(1)取白色粉末A,向其中加入足量水,充分搅拌后过滤,得到白色沉淀B和无色滤液C,由此可判断,原白色粉末中一定不含有______.CuSO4
(2)向白色沉淀B中加入足量稀盐酸,沉淀全部溶解,并产生无色气体.由此可判断,原白色粉末中一定含有______.
(3)向无色滤液C中通入一定量二氧化碳,充分反应后过滤,得到白色沉淀D和无色滤液E,由此可判断,原白色粉末中一定还含有______.
(4)若流程图中无色滤液E中只含一种溶质,则无色滤液E中的溶质为______.
碘酸钾是一种白色粉末,无臭无味,加碘食盐中常加入它,国家规定每千克食盐中应含40~50 mg碘酸钾酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物制质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氢酸盐等氧化为高碘酸钾.碘酸钾在常温下稳定,加热至560℃开始分解.工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:6I2+11KClO3+3H2O-6KH(IO3)2+5KCl+3Cl2

1、④的操作名称可能是________.
2、步骤②中,用稀硝酸酸化而不用氢碘酸(HI),其原因可能是________;
3、步骤③要保持溶液微沸1小时是为了排出________,排出该物质的原因为________;
4、X的化学式为________写出用试剂X调节pH的化学方程式________.
5、实验中涉及两次过滤,在实验室进行过滤实验中,用到的玻璃仪器有________;
6、已知:IO3-+I-+H+→I2+H2O(未配平),I2+2S2O32-→2I-+S4O62-.某学生测定食用精制盐的碘化钾的含量,其步骤为
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.加入物质的量浓度为2.0×10-3 mol·L-1的Na2S2O3溶液40.0 mL;
d.以淀粉为指示剂,逐滴加入1.00×10-3 mol·L-1碘水10.0 mL恰好反应完全.
Ⅰ.判断d中恰好反应完全的现象是________.
Ⅱ.配平方程式:________IO3-+________I-+________H+→________I2+________H2O
Ⅲ.根据以上实验,所测精制盐中碘酸钾含量是(以含w的代数式表示)________mg/kg.