摘要:有一废水样品10L.经分析得知游离(Cl2)的浓度为0.012mol/L.废水中的H+浓度 为0.001mol/L.已知Cl2和Na2SO3在溶液中有如下反应:Cl2+Na2SO3+H2O=Na2SO4+2HCl 现欲除去其中的游离氯.并成为中性溶液.问: (1)需加入浓度0.1mol/L的Na2SO3溶液多少升?(2)需加入固体烧碱多少克?
网址:http://m.1010jiajiao.com/timu3_id_157943[举报]
有一废水样品10L,经分析得知含游离氯(Cl2)浓度为0.012mol/L,其H+浓度为1×10—3mol/L。已知Cl2+Na2SO3+H2O=Na2SO4+2HCl。现欲除去其中的游离氯,并成为中性溶液,问需加浓度为0.1mol/L的Na2SO3溶液的体积是多少?需加入固体烧碱的质量是多少?
查看习题详情和答案>>
有一废水样品10L,经过分析得知游离氯(Cl2)的浓度为0.012mol×L-1,废水中的H+浓度为0.001mol×L-1。已知Cl2和Na2SO3在溶液中有如下反应:
Cl2+Na2SO3+H2O══Na2SO4+2HCl
现欲除去其中的游离氯,并成为中性溶液,问:
(1)需加入浓度为0.1mol×L-1的Na2SO3溶液多少升?
(2)需加入固体烧碱多少克?
查看习题详情和答案>>
有一废水样品10L,经过分析得知游离氯(Cl2)的浓度为0.012mol×L-1,废水中的H+浓度为0.001mol×L-1。已知Cl2和Na2SO3在溶液中有如下反应:
Cl2+Na2SO3+H2O══Na2SO4+2HCl
现欲除去其中的游离氯,并成为中性溶液,问:
(1)需加入浓度为0.1mol×L-1的Na2SO3溶液多少升?
(2)需加入固体烧碱多少克?
查看习题详情和答案>>
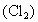 的浓度为
的浓度为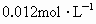 ,废水中的
,废水中的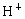 浓度为
浓度为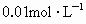 .已知
.已知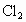 和
和 在溶液中有如下反应
在溶液中有如下反应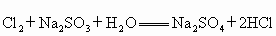 .
.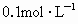 的
的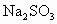 溶液多少升?
溶液多少升?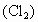 的浓度为
的浓度为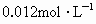 ,废水中的
,废水中的 浓度为
浓度为 .已知
.已知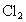 和
和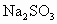 在溶液中有如下反应
在溶液中有如下反应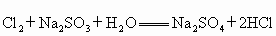 .
.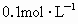 的
的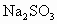 溶液多少升?
溶液多少升?