摘要:据下列四个反应:(1)H2S+I2====2H++2I-+S↓,(2)H2SO3+2H2S====3S↓+3H2O, (3)2I-+Br2====I2+2Br-,(4)H2SO3+I2+H2O====4H++2I-+SO, 确定Br-.I-.H2S.H2SO3的还原性由强到弱的顺序是( ) A.H2S>H2SO3>I->Br- B.Br->I->H2SO3>H2S C.H2S>I->Br->H2SO3 D.I->Br->H2S>H2SO3 解析:本题旨在考查氧化还原反应由强到弱的规律.强化学生对于氧化剂的氧化性强于氧化产物的氧化性.还原剂的还原性强于还原产物的还原性的认识.因此.找出反应前后氧化剂和氧化产物.还原剂和还原产物.即可解决问题. 答案:A
网址:http://m.1010jiajiao.com/timu3_id_157918[举报]
(1)写出Fe2(SO4)3在水溶液中的电离方程式:
(2)写出下列离子方程式对应的一个化学方程式:2H++CO32-=H2O+CO2↑
(3)用“双线桥法”标明电子转移的方向和数目.
MnO2+4HCl
MnCl2+Cl2↑+2H2O
该反应中氧化剂与还原剂物质的量之比为
该反应的离子方程式为
(4)根据下列四个反应:
①Cl2+2KI=2KCl+I2 ②2FeCl2+Cl2=2FeCl3
③2FeCl3+2HI=2FeCl2+2HCl+I2 ④H2S+I2=S+2HI
可以判断FeCl3、Cl2、I2、S四种物质的氧化性由强到弱的正确顺序是
查看习题详情和答案>>
Fe2(SO4)3=2Fe2++3SO42-
Fe2(SO4)3=2Fe2++3SO42-
(2)写出下列离子方程式对应的一个化学方程式:2H++CO32-=H2O+CO2↑
HCl+NaHCO3-=H2O+NaCl+CO2↑
HCl+NaHCO3-=H2O+NaCl+CO2↑
(3)用“双线桥法”标明电子转移的方向和数目.
MnO2+4HCl
| ||
该反应中氧化剂与还原剂物质的量之比为
1:2
1:2
该反应的离子方程式为
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
| ||
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
| ||
(4)根据下列四个反应:
①Cl2+2KI=2KCl+I2 ②2FeCl2+Cl2=2FeCl3
③2FeCl3+2HI=2FeCl2+2HCl+I2 ④H2S+I2=S+2HI
可以判断FeCl3、Cl2、I2、S四种物质的氧化性由强到弱的正确顺序是
Cl2>FeCl3>I2>S
Cl2>FeCl3>I2>S
.下列四个反应中,酸所体现的性质与其他三者有所不同的是
A.Cu+2H2SO4CuSO4+SO2↑+2H2O
B.H2S+H2SO4S↓+SO2↑+2H2O
C.Ag+2HNO3AgNO3+NO2↑+H2O
D.3Fe3O4+28HNO39Fe(NO3)3+NO↑+14H2O
查看习题详情和答案>>
下列四个反应中,酸所体现的性质与其他三者有所不同的是
A.Cu+2H2SO4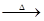 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
B.H2S+H2SO4 S↓+SO2↑+2H2O
S↓+SO2↑+2H2O
C.Ag+2HNO3 AgNO3+NO2↑+H2O
AgNO3+NO2↑+H2O
D.3Fe3O4+28HNO3 9Fe(NO3)
3+NO↑+14H2O
9Fe(NO3)
3+NO↑+14H2O
查看习题详情和答案>>
(1)写出Fe2(SO4)3在水溶液中的电离方程式:______
(2)写出下列离子方程式对应的一个化学方程式:2H++CO32-=H2O+CO2↑______
(3)用“双线桥法”标明电子转移的方向和数目.
MnO2+4HCl
MnCl2+Cl2↑+2H2O
该反应中氧化剂与还原剂物质的量之比为______
该反应的离子方程式为______
(4)根据下列四个反应:
①Cl2+2KI=2KCl+I2 ②2FeCl2+Cl2=2FeCl3
③2FeCl3+2HI=2FeCl2+2HCl+I2 ④H2S+I2=S+2HI
可以判断FeCl3、Cl2、I2、S四种物质的氧化性由强到弱的正确顺序是______.
查看习题详情和答案>>
(2)写出下列离子方程式对应的一个化学方程式:2H++CO32-=H2O+CO2↑______
(3)用“双线桥法”标明电子转移的方向和数目.
MnO2+4HCl
| ||
该反应中氧化剂与还原剂物质的量之比为______
该反应的离子方程式为______
(4)根据下列四个反应:
①Cl2+2KI=2KCl+I2 ②2FeCl2+Cl2=2FeCl3
③2FeCl3+2HI=2FeCl2+2HCl+I2 ④H2S+I2=S+2HI
可以判断FeCl3、Cl2、I2、S四种物质的氧化性由强到弱的正确顺序是______.