摘要:实验:分别向H2SO4.Na2SO4.Na2CO3.Na2SO3.Na3PO4五种溶液中先加入BaCl2溶液.再加入稀盐酸.各产生什么现象?写出有关反应的离子方程式. 小结:实验室检验硫酸根离子的操作方法是 . 思考:(1)若向某无色溶液中先加入BaCl2溶液.有白色沉淀出现.再加入稀盐酸.沉淀不消失.可由此判断此溶液中含有SO吗?为什么? (2)向Na2SO3溶液中先加BaCl2溶液产生白色沉淀.再加稀HNO3沉淀没有溶解,向Na2SO3溶液中先加稀HNO3酸化.再加BaCl2也产生了白色沉淀. 这是为什么? [例1]向50 mL 18 mol·L-1 H2SO4溶液中加入足量的铜片并加热.充分反应后.被还原的H2SO4的物质的量 A.小于0.45 mol B.等于0.45 mol C.在0.45 mol和0.90 mol之间 D.大于0.90 mol [例2]三位学生设计了下述三个方案.并都认为:如果观察到的现象和自己设计的方案一致.即可确证试液中有SO. 足量稀HCl BaCl2溶液 方案甲: 试液 白色沉淀 沉淀不溶解 BaCl2溶液 足量稀HCl 方案乙: 试液 无沉淀 白色沉淀 Ba(NO3)2溶液 足量稀HNO3 方案丙: 试液 无沉淀 白色沉淀 试评价上述各方案是否严密.并分别说明理由. 答:方案甲 方案乙 方案丙 [例3]浓硫酸具有A.强酸性B.强氧化性C.高沸点.低挥发性.D.脱水性.E.吸水性等性质.以下过程主要表现了浓硫酸的哪些性质?请将答案的字母分别填入括号中 (1)用NaCl固体和浓H2SO4在加热条件下制氯化氢气体.( ) (2)用磷矿粉(主要成分Ca3(PO4)2)和硫酸反应制磷酸.( ) (3)热的浓硫酸分别与铜片.木炭和硫粉等反应.( ) (4)浓硫酸干燥H2.O2.Cl2.HCl和SO2等气体.( ) (5)常温下可以用铁或铝的容器贮存浓硫酸.( ) (6)胆矾放在盛浓硫酸的干燥器中变成白色粉末.( ) (7)不能用浓硫酸干燥HBr.HI和H2S等气体.( ) (8)浓硫酸使湿润的蓝色石蕊试纸先变红后变黑.( ) [例4]实验证明铜不能在低温下与氧气反应.铜不与稀硫酸反应.但工业上却在废铜屑与热的稀硫酸混合物中.通入空气制硫酸铜溶液.(1)写出上述反应的化学方程式 .(2)利用铜制备硫酸铜溶液还有什么方法?写出反应的化学方程式 .比较哪一种方法好?为什么? [例5]将质量分数为p%的硫酸与等体积的水混合后得到质量分数为q%的硫酸.则下列关于p.q的关系式中正确的是 A.q<p<2q B.p<2q C.p=2q D.p≥2q [例6](1)浓硫酸与木炭粉在加热条件下反应的化学方程式是: . (2)试用下图6-3所列各装置设计一个实验.来验证上述反应所产生的各种产物. 编号 ① ② ③ ④ 装置 图6-3 这些装置的连接顺序(按产物气流从左至右的方向)是: → → → . (3)实验时可观察到装置①中A瓶的溶液褪色.C瓶的溶液不褪色.A瓶溶液的作用是 .B瓶溶液的作用是 .C瓶溶液的作用是 . (4)装置②中所加固体药品是 .可验证的产物是 .确定装置②在整套装置中位置的理由是 . (5)装置③中所盛溶液是 .可验证的产物是 . [例7]现有Na2SO3溶液和稀H2SO4两种溶液. 设计一个实验区别它们.所用试剂只有BaCl2溶液.仪器只有试管.试写出鉴别过程和结论. 第七章 总复习
网址:http://m.1010jiajiao.com/timu3_id_157910[举报]
(2011?怀柔区模拟)短周期元素组成的四种物质A、B、C、D均溶于水,A、C焰色反应呈黄色.取四种物质的溶液进行如下实验:
①分别向A、B中加BaCl2均生成白色沉淀,再滴加稀HNO3,A中沉淀溶解并产生无色无味且能使澄清石灰水变浑浊的气体,B中无变化.
②物质的量浓度相同的A、B、C三种溶液,当A、B以体积比1:2混合时生成无色气体;B、C以1:2体积比混合,加热生成能使湿润的红色石蕊试纸变蓝的气体.如果均以1:1混合,均无气体生成.
③D+AgNO3→不溶于稀HNO3的白色沉淀.
④向D中逐滴滴加C生成白色沉淀,继续滴加至过量,沉淀逐渐减少,最后完全溶解.
请回答
(1)D中阴离子在周期表中的位置
(2)A溶液的PH
(3)A、D两溶液混合,有气体和白色沉淀产生,写出反应的离子方程式:
(4)将②中产生的两种气体通入浓CaCl2溶液中可制备纳米级碳酸钙,制备时应先通入
(5)设计实验验证所得样品颗粒是否为纳米级
查看习题详情和答案>>
①分别向A、B中加BaCl2均生成白色沉淀,再滴加稀HNO3,A中沉淀溶解并产生无色无味且能使澄清石灰水变浑浊的气体,B中无变化.
②物质的量浓度相同的A、B、C三种溶液,当A、B以体积比1:2混合时生成无色气体;B、C以1:2体积比混合,加热生成能使湿润的红色石蕊试纸变蓝的气体.如果均以1:1混合,均无气体生成.
③D+AgNO3→不溶于稀HNO3的白色沉淀.
④向D中逐滴滴加C生成白色沉淀,继续滴加至过量,沉淀逐渐减少,最后完全溶解.
请回答
(1)D中阴离子在周期表中的位置
第三周期 VIIA族
第三周期 VIIA族
;C的电子式Na+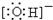
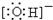
Na+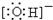
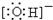
(2)A溶液的PH
>
>
7(填>=<=),原因:CO32-+H2O HCO3-+OH-
HCO3-+OH-
 HCO3-+OH-
HCO3-+OH-CO32-+H2O HCO3-+OH-
HCO3-+OH-
 HCO3-+OH-
HCO3-+OH-(3)A、D两溶液混合,有气体和白色沉淀产生,写出反应的离子方程式:
2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑
2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑
(4)将②中产生的两种气体通入浓CaCl2溶液中可制备纳米级碳酸钙,制备时应先通入
NH3
NH3
气体(填化学式),写出反应的化学方程式CaCl2+CO2+2NH3+H2O=CaCO3↓+2NH4Cl
CaCl2+CO2+2NH3+H2O=CaCO3↓+2NH4Cl
(5)设计实验验证所得样品颗粒是否为纳米级
取少量样品和水混合形成分散系,用一束光照射,若出现一条光的通路则是,否则不是
取少量样品和水混合形成分散系,用一束光照射,若出现一条光的通路则是,否则不是
.小军在实验室里做了下列实验:
①分别向盛有稀硫酸和稀盐酸的试管中,滴加紫色石蕊试液;②向盛有稀硫酸的试管中,滴加氢氧化钠试液;③向盛有锌粒的试营中,分别滴加稀盐酸和稀硫酸;④将一根生锈的铁钉分别放入盛有稀盐酸和稀硫酸的试管中,过一会儿取出。
他在纸上记录了以下现象:
a. 溶液没有明显现象;b. 溶液变为黄色;c. 溶液显红色;d. 产生气泡,溶液无色。
下面请你来整理完成实验报告。
(1)实验目的:探究__________(填写物质类别)的化学性质。
(2)实验现象:产生a现象的实验所对应的一类反应通常被我们称作__________反应(该反应属于复分解反应)。
(3)上题所涉及的这类反应在日常生活和工农业生产中有广泛的应用。请举出一个利用该反应的实例:______________________________。
查看习题详情和答案>>
短周期元素组成的四种物质A、B、C、D均溶于水,A、C焰色反应呈黄色.取四种物质的溶液进行如下实验:
①分别向A、B中加BaCl2均生成白色沉淀,再滴加稀HNO3,A中沉淀溶解并产生无色无味且能使澄清石灰水变浑浊的气体,B中无变化.
②物质的量浓度相同的A、B、C三种溶液,当A、B以体积比1:2混合时生成无色气体;B、C以1:2体积比混合,加热生成能使湿润的红色石蕊试纸变蓝的气体.如果均以1:1混合,均无气体生成.
③D+AgNO3→不溶于稀HNO3的白色沉淀.
④向D中逐滴滴加C生成白色沉淀,继续滴加至过量,沉淀逐渐减少,最后完全溶解.
请回答
(1)D中阴离子在周期表中的位置______;C的电子式______
(2)A溶液的PH______7(填>=<=),原因:______
(3)A、D两溶液混合,有气体和白色沉淀产生,写出反应的离子方程式:______
(4)将②中产生的两种气体通入浓CaCl2溶液中可制备纳米级碳酸钙,制备时应先通入______气体(填化学式),写出反应的化学方程式______
(5)设计实验验证所得样品颗粒是否为纳米级______.
查看习题详情和答案>>
①分别向A、B中加BaCl2均生成白色沉淀,再滴加稀HNO3,A中沉淀溶解并产生无色无味且能使澄清石灰水变浑浊的气体,B中无变化.
②物质的量浓度相同的A、B、C三种溶液,当A、B以体积比1:2混合时生成无色气体;B、C以1:2体积比混合,加热生成能使湿润的红色石蕊试纸变蓝的气体.如果均以1:1混合,均无气体生成.
③D+AgNO3→不溶于稀HNO3的白色沉淀.
④向D中逐滴滴加C生成白色沉淀,继续滴加至过量,沉淀逐渐减少,最后完全溶解.
请回答
(1)D中阴离子在周期表中的位置______;C的电子式______
(2)A溶液的PH______7(填>=<=),原因:______
(3)A、D两溶液混合,有气体和白色沉淀产生,写出反应的离子方程式:______
(4)将②中产生的两种气体通入浓CaCl2溶液中可制备纳米级碳酸钙,制备时应先通入______气体(填化学式),写出反应的化学方程式______
(5)设计实验验证所得样品颗粒是否为纳米级______.
查看习题详情和答案>>
短周期元素组成的四种物质A、B、C、D均溶于水,A、C焰色反应呈黄色.取四种物质的溶液进行如下实验:
①分别向A、B中加BaCl2均生成白色沉淀,再滴加稀HNO3,A中沉淀溶解并产生无色无味且能使澄清石灰水变浑浊的气体,B中无变化.
②物质的量浓度相同的A、B、C三种溶液,当A、B以体积比1:2混合时生成无色气体;B、C以1:2体积比混合,加热生成能使湿润的红色石蕊试纸变蓝的气体.如果均以1:1混合,均无气体生成.
③D+AgNO3→不溶于稀HNO3的白色沉淀.
④向D中逐滴滴加C生成白色沉淀,继续滴加至过量,沉淀逐渐减少,最后完全溶解.
请回答
(1)D中阴离子在周期表中的位置______;C的电子式______
(2)A溶液的PH______7(填>=<=),原因:______
(3)A、D两溶液混合,有气体和白色沉淀产生,写出反应的离子方程式:______
(4)将②中产生的两种气体通入浓CaCl2溶液中可制备纳米级碳酸钙,制备时应先通入______气体(填化学式),写出反应的化学方程式______
(5)设计实验验证所得样品颗粒是否为纳米级______.
查看习题详情和答案>>
①分别向A、B中加BaCl2均生成白色沉淀,再滴加稀HNO3,A中沉淀溶解并产生无色无味且能使澄清石灰水变浑浊的气体,B中无变化.
②物质的量浓度相同的A、B、C三种溶液,当A、B以体积比1:2混合时生成无色气体;B、C以1:2体积比混合,加热生成能使湿润的红色石蕊试纸变蓝的气体.如果均以1:1混合,均无气体生成.
③D+AgNO3→不溶于稀HNO3的白色沉淀.
④向D中逐滴滴加C生成白色沉淀,继续滴加至过量,沉淀逐渐减少,最后完全溶解.
请回答
(1)D中阴离子在周期表中的位置______;C的电子式______
(2)A溶液的PH______7(填>=<=),原因:______
(3)A、D两溶液混合,有气体和白色沉淀产生,写出反应的离子方程式:______
(4)将②中产生的两种气体通入浓CaCl2溶液中可制备纳米级碳酸钙,制备时应先通入______气体(填化学式),写出反应的化学方程式______
(5)设计实验验证所得样品颗粒是否为纳米级______.
短周期元素组成的四种物质A、B、C、D均溶于水,A、C焰色反应呈黄色.取四种物质的溶液进行如下实验:
①分别向A、B中加BaCl2均生成白色沉淀,再滴加稀HNO3,A中沉淀溶解并产生无色无味且能使澄清石灰水变浑浊的气体,B中无变化.
②物质的量浓度相同的A、B、C三种溶液,当A、B以体积比1:2混合时生成无色气体;B、C以1:2体积比混合,加热生成能使湿润的红色石蕊试纸变蓝的气体.如果均以1:1混合,均无气体生成.
③D+AgNO3→不溶于稀HNO3的白色沉淀.
④向D中逐滴滴加C生成白色沉淀,继续滴加至过量,沉淀逐渐减少,最后完全溶解.
请回答
(1)D中阴离子在周期表中的位置______;C的电子式______
(2)A溶液的PH______7(填>=<=),原因:______
(3)A、D两溶液混合,有气体和白色沉淀产生,写出反应的离子方程式:______
(4)将②中产生的两种气体通入浓CaCl2溶液中可制备纳米级碳酸钙,制备时应先通入______气体(填化学式),写出反应的化学方程式______
(5)设计实验验证所得样品颗粒是否为纳米级______.
查看习题详情和答案>>
①分别向A、B中加BaCl2均生成白色沉淀,再滴加稀HNO3,A中沉淀溶解并产生无色无味且能使澄清石灰水变浑浊的气体,B中无变化.
②物质的量浓度相同的A、B、C三种溶液,当A、B以体积比1:2混合时生成无色气体;B、C以1:2体积比混合,加热生成能使湿润的红色石蕊试纸变蓝的气体.如果均以1:1混合,均无气体生成.
③D+AgNO3→不溶于稀HNO3的白色沉淀.
④向D中逐滴滴加C生成白色沉淀,继续滴加至过量,沉淀逐渐减少,最后完全溶解.
请回答
(1)D中阴离子在周期表中的位置______;C的电子式______
(2)A溶液的PH______7(填>=<=),原因:______
(3)A、D两溶液混合,有气体和白色沉淀产生,写出反应的离子方程式:______
(4)将②中产生的两种气体通入浓CaCl2溶液中可制备纳米级碳酸钙,制备时应先通入______气体(填化学式),写出反应的化学方程式______
(5)设计实验验证所得样品颗粒是否为纳米级______.
查看习题详情和答案>>