网址:http://m.1010jiajiao.com/timu3_id_157656[举报]
B.第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
C.硒与硫同族,硒酸的化学式为H2SeO4
D.第三周期金属元素的最高价氧化物对应的水化物,其碱性随原子序数的增大而增强
|
硒位于元素周期表中第4周期ⅥA族,下列对硒元素的有关叙述中,正确的是 | |
A. |
硒化氢比硫化氢稳定 |
B. |
硒与氢气比砷(位于周期表中第4周期ⅤA族)与氢气更容易反应 |
C. |
硒酸的酸性比硫酸的酸性强 |
D. |
硒的原子半径比硫的大 |
下图是由Emil Zmaczynski设计的金字塔式元素周期表的一部分,图上标有第ⅥA族和几种元素的位置。请回答下列问题: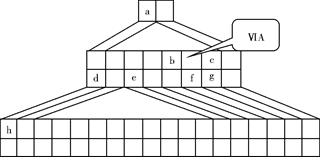
(1)请在上图中将铁元素所在族的位置全部涂黑。
(2)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是:氢的最外层电子“饱和缺一”。请写出NaH的电子式 。
(3)b元素的氢化物与其最高价氧化物的水化物可生成一种盐,土壤中施用该盐做化肥时,其阴离子在水田中的利用率低,说明土壤胶体粒子带 (“正”或“负”)电荷。
(4)下列叙述正确的是 。
| A.h的最高价氧化物对应的水化物是一种强碱 |
| B.硒化氢的稳定性强于f的氢化物的稳定性 |
| C.c的氢化物的水溶液是强酸 |
| D.原子半径:h>e>a |
(5)d的某化合物呈淡黄色,可与氯化亚铁溶液反应生成红褐色沉淀和能使带火星的木条复燃的气体,若沉淀和气体的物质的量之比为2∶1,反应的离子方程式为 。 查看习题详情和答案>>
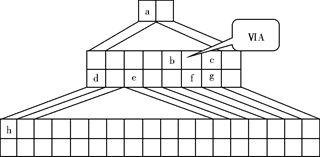
(1)请在上图中将铁元素所在族的位置全部涂黑。
(2)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是:氢的最外层电子“饱和缺一”。请写出NaH的电子式 。
(3)b元素的氢化物与其最高价氧化物的水化物可生成一种盐,土壤中施用该盐做化肥时,其阴离子在水田中的利用率低,说明土壤胶体粒子带 (“正”或“负”)电荷。
(4)下列叙述正确的是 。
| A.h的最高价氧化物对应的水化物是一种强碱 |
| B.硒化氢的稳定性强于f的氢化物的稳定性 |
| C.c的氢化物的水溶液是强酸 |
| D.原子半径:h>e>a |
(5)d的某化合物呈淡黄色,可与氯化亚铁溶液反应生成红褐色沉淀和能使带火星的木条复燃的气体,若沉淀和气体的物质的量之比为2∶1,反应的离子方程式为 。
下图是由Emil Zmaczynski设计的金字塔式元素周期表的一部分,图上标有第ⅥA族和几种元素的位置.请回答下列问题:
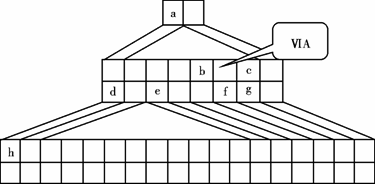
(1)请在上图中将铁元素所在族的位置全部涂黑.
(2)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是:氢的最外层电子“饱和缺一”.请写出NaH的电子式________.
(3)b元素的氢化物与其最高价氧化物的水化物可生成一种盐,土壤中施用该盐做化肥时,其阴离子在水田中的利用率低,说明土壤胶体粒子带________(“正”或“负”)电荷.
(4)下列叙述正确的是________.
A.h的最高价氧化物对应的水化物是一种强碱
B.硒化氢的稳定性强于f的氢化物的稳定性
C.c的氢化物的水溶液是强酸
D.原子半径:h>e>a
E.相同条件下,d与f形成的化合物水溶液的pH大于d与g形成的化合物水溶液的pH,说明相同浓度氢化物水溶液的酸性f弱于g
(5)d的某化合物呈淡黄色,可与氯化亚铁溶液反应生成红褐色沉淀和能使带火星的木条复燃的气体,若沉淀和气体的物质的量之比为2∶1,反应的离子方程式为________.