摘要:16.在短周期主族元素中.属于非金属元素的有 12种 (D)13种
网址:http://m.1010jiajiao.com/timu3_id_157312[举报]
短周期主族元素A、B、C、D、E、F的原子序数依次增大,它们的原子核外电子层数之和为13.B的化合物种类繁多,数目庞大;C、D是空气中含量最多的两种元素,D、E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素.试回答以下问题:
(1)写出D与E以1:1的原子个数比形成的化合物的电子式:
 .F的原子结构示意图为
.F的原子结构示意图为
 .
.
(2)B、D形成的化合物BD2中存在的化学键为
(3)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性.则甲、乙反应的离子方程式为
(4)A、C、D、E的原子半径由大到小的顺序是
(5)元素B和F的非金属性强弱,B的非金属性
查看习题详情和答案>>
(1)写出D与E以1:1的原子个数比形成的化合物的电子式:




(2)B、D形成的化合物BD2中存在的化学键为
共价
共价
键(填“离子”或“共价”,下同).A、C、F三种元素形成的化合物CA4F为离子
离子
化合物.(3)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性.则甲、乙反应的离子方程式为
OH-+HCO3-═CO32-+H2O
OH-+HCO3-═CO32-+H2O
.(4)A、C、D、E的原子半径由大到小的顺序是
Na>N>O>H
Na>N>O>H
(用元素符号表示).(5)元素B和F的非金属性强弱,B的非金属性
弱
弱
于F(填“强”或“弱”),并用化学方程式证明上述结论Na2CO3+2HClO4═CO2↑+H2O+2NaClO4
Na2CO3+2HClO4═CO2↑+H2O+2NaClO4
.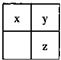 短周期主族元素x、y、z在元素周期表中的相对位置如图,下列推论合理的是( )
短周期主族元素x、y、z在元素周期表中的相对位置如图,下列推论合理的是( )| A、若y和z能形成化合物,则x为氮元素 | B、若x、y、z的单质常温下都是气体,则Y为氧元素 | C、若x、y、z是非金属元素,则它们气态氢化物的水溶液都显酸性 | D、若x、y、z的原子序数之和小于20,则它们都是金属元素 |
短周期主族元素X、Y、Z 在周期表中的位置如表所示.下列说法正确的是( )
| Z | |
| X | Y |
| A、Z元素的最高化合价一定大于X元素 |
| B、它们对应最简单气态氢化物的沸点由高到低的顺序一定是Y>X>Z |
| C、若它们的原子最外层电子数之和为11,则它们均为非金属元素 |
| D、若它们均为非金属元素,则X与氧元素组成的物质一定是酸性氧化物 |
 (1)在短周期主族元素中,氯及其相邻元素的电负性由大到小的顺序是
(1)在短周期主族元素中,氯及其相邻元素的电负性由大到小的顺序是(2)A、B、C为同一短周期金属元素.依据下表数据分析,C元素在化合物中的主要化合价为
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 500 | 4600 | 6900 | 9500 |
| B | 740 | 1500 | 7700 | 10500 |
| C | 580 | 1800 | 2700 | 11600 |
(4)R是1~36号元素中未成对电子数最多的原子.R3+在溶液中存在如下转化关系:R3+
| OH- |
| H+ |
| ||
| H+ |
①基态R原子的价电子排布式为
②[R(OH)4]-中存在的化学键是
A.离子键 B.极性键 C.非极性键 D.配位键. 查看习题详情和答案>>
(1)在短周期主族元素中,氯及其相邻元素的电负性由大到小的顺序是 (用元素符号表示)
(2)A、B、C为同一短周期金属元素。依据下表数据分析,C元素在化合物中的主要化合价为 ;第二电离能(I2)B小于A的原因是 。
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 500 | 4600 | 6900 | 9500 |
| B | 740 | 1500 | 7700 | 10500 |
| C | 580 | 1800 | 2700 | 11600 |
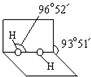
(3)已知过氧化氢分子的空间结构如右图所示,分子中氧原子采取 杂化;通常情况下,H2O2与水任意比互溶的主要原因是 。
(4)R是1~36号元素中未成对电子数最多的原子。R3+在溶液中存在如下转化关系:
R3+ R(OH)3
[R(OH)4]-
①基态R原子的价电子排布式为 。
②[R(OH)4]-中存在的化学键是 。
A.离子键 B.极性键 C.非极性键 D.配位键
查看习题详情和答案>>