摘要:卤族元素性质的特殊性 (1)氟元素:①CaF2不溶于水.AgF溶于水 ②HF为弱酸.其它氢卤酸为强酸 ③F-不能被氧化剂氧化.其它卤离子均能被氧化 ④HF能腐蚀玻璃.其它氢卤酸不能腐蚀玻璃 ⑤氟无正价.无含氧酸.其它卤素都有正价.有含氧酸. ⑥F2与水反应生成HF和O2.其它卤素有单质的水溶液 (2)溴元素:Br2为绿红棕色液体.很易挥发.冰封保存 (3)碘元素: ①I2遇淀粉溶液呈蓝色(用于鉴定I2的存在) ②I2受热升华 ③I2+Fe=FeI2(I2氧化性弱.盛I2的试剂瓶不能用铁盖)
网址:http://m.1010jiajiao.com/timu3_id_155363[举报]
某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素碳与硅的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红色试纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.
根据图1回答:
(1)写出选用物质的名称:A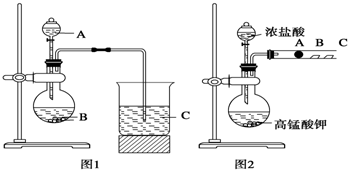
C
(2)烧瓶中反应的离子方程式为
烧杯中反应的离子方程式为
根据图2回答:
(3)乙同学的实验原理是
(4)B处的实验现象是
(5)B处的反应的离子方程式:
查看习题详情和答案>>
根据图1回答:
(1)写出选用物质的名称:A
硝酸
硝酸
,B碳酸钙
碳酸钙

C
硅酸钠溶液
硅酸钠溶液
;(2)烧瓶中反应的离子方程式为
CaCO3+2H+=Ca2++CO2+H2O
CaCO3+2H+=Ca2++CO2+H2O
;烧杯中反应的离子方程式为
SiO32-+CO2+H2O═H2SiO3↓+CO32-(CO2不足),或SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3-(CO2过量)
SiO32-+CO2+H2O═H2SiO3↓+CO32-(CO2不足),或SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3-(CO2过量)
;根据图2回答:
(3)乙同学的实验原理是
强氧化剂生成弱氧化剂或活泼的非金属单质置换出较不活泼的非金属单质
强氧化剂生成弱氧化剂或活泼的非金属单质置换出较不活泼的非金属单质
;(4)B处的实验现象是
湿润的淀粉KI试纸变蓝
湿润的淀粉KI试纸变蓝
;(5)B处的反应的离子方程式:
2I-+Cl2?I2+2Cl-
2I-+Cl2?I2+2Cl-
.
某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究,A、B、C三处分别是HNO3溶液、Na2CO3溶液、Na2SiO3溶液;乙同学设计了如图2装置来验证卤族元素性质的递变规律.A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.
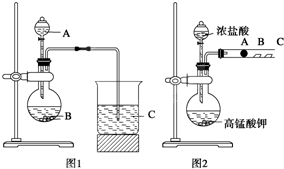
(1)写出甲同学(图1)仪器的名称:A ,B ,C_ ;
(2)图1中各反应的离子方程式分别为 ;
(3)写出乙同学设计的B处的离子方程式: .
(4)写出乙同学设计的C处的实验现象 .
查看习题详情和答案>>

(1)写出甲同学(图1)仪器的名称:A
(2)图1中各反应的离子方程式分别为
(3)写出乙同学设计的B处的离子方程式:
(4)写出乙同学设计的C处的实验现象
 某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素C和Si的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律,图2中A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.
某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素C和Si的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律,图2中A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.(1)从以下所给物质中选出甲同学设计的实验所用到物质:图1中试剂A、B为(填序号)
①、④
①、④
;①稀硫酸溶液; ②浓盐酸; ③石灰石;④碳酸钠粉末;⑤Na2SO3溶液
写出图1烧瓶中发生反应的离子方程式
CaCO3+2H+=Ca2++CO2↑+H2O
CaCO3+2H+=Ca2++CO2↑+H2O
;(2)甲同学所做实验图1烧杯中现象为
出现白色沉淀
出现白色沉淀
;(3)乙同学所做实验图2中B处的现象为
湿润的淀粉KI试纸变蓝
湿润的淀粉KI试纸变蓝
;(4)写出图2中A处发生反应的离子方程式:
Cl2+2Br-=Br2+2Cl-
Cl2+2Br-=Br2+2Cl-
.某研究性学习小组设计了一组实验来探究元素周期律.
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素非金属性强弱比较的实验研究;
乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红色纸条.
已知常温下浓盐酸与高锰酸钾能反应生成氯气.
可选择的试剂有:大理石、碳酸钠粉末、浓盐酸、稀硝酸、硅酸钠溶液.

(1)甲同学实验中(图1):
①从给出试剂中选出最佳物质:A
②烧杯C中发生反应的离子方程式为
(2)乙同学实验中(图2):
①写出A处反应的离子方程式
②B处实验现象是
③若高锰酸钾的还原产物为Mn2+,当有0.04mol高锰酸钾参加反应时,则可生成标准状况下的氯气的体积为
查看习题详情和答案>>
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素非金属性强弱比较的实验研究;
乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红色纸条.
已知常温下浓盐酸与高锰酸钾能反应生成氯气.
可选择的试剂有:大理石、碳酸钠粉末、浓盐酸、稀硝酸、硅酸钠溶液.

(1)甲同学实验中(图1):
①从给出试剂中选出最佳物质:A
HNO3
HNO3
,BCaCO3
CaCO3
.(填化学式)②烧杯C中发生反应的离子方程式为
CO2+SiO32-+H2O=H2SiO3↓+CO32-
CO2+SiO32-+H2O=H2SiO3↓+CO32-
.(2)乙同学实验中(图2):
①写出A处反应的离子方程式
Cl2+2Br-=Br2+2Cl-
Cl2+2Br-=Br2+2Cl-
.②B处实验现象是
试纸变蓝
试纸变蓝
.③若高锰酸钾的还原产物为Mn2+,当有0.04mol高锰酸钾参加反应时,则可生成标准状况下的氯气的体积为
2.24
2.24
L.某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律。图2中,A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。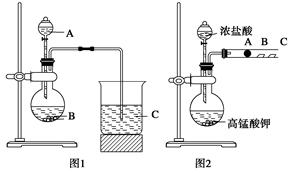
甲同学实验中选用的物质名称为:A____________,B__________,C____________;
C处反应的离子方程式为________________________ 。
写出乙同学的实验中圆底烧瓶中发生反应的化学方程式______________________ ,
A处反应的离子方程式为_________________________;B处的实验现象为 ___________________________。