摘要:阿伏加德罗常数的近似值为6.02×1023mol-1 (即:每摩尔物质中约含有微粒数为6.02×1023) [应用与实践1] (1).1mol金刚石中约含有 个碳原子. (2).1mol氧气中约含有 个氧分子, 个氧原子. (3).1mol氯化钠中约含有 个钠离子, 个氯离子. (4).请你仿照上述举例说说.(你能否知道某些物质是由什么微粒构成的) (5).2mol水银中含有 个汞原子. (6).0.5mol水中含有 个水分子. 个氢原子. 个氧原子. (7).3molNa2SO4中含有 个Na+和 个SO42-. 补充:如何判断一种物质是由分子.原子.离子构成的呢? 金 属: 单 质 非金属: 纯净物 酸: 碱: 无机物 盐: 化合物 金属氧化物: 氧化物 非金属氧化物: 有机物: (8).你能能说说1mol下列物质中所含的微粒个数吗? ①H2 ②Cu ③H2SO4 ④NaOH ⑤Na2CO3 ⑥H2O ⑦CH4 “米 是长度的单位. “摩尔 是“物质的量 的单位. “物质的量 和长度一样.都是国际单位制中的基本物理量.其符号是“n .单位是“mol .问“物质的量 是多少.要带上“mol . [应用与实践2] ⑴ 含有阿伏加德罗常数个碳原子的物质的量为 , ⑵ 6.02×1023个氧分子的物质的量为 .其中氧原子的物质的量为 , ⑶ 1.204×1024个二氧化碳分子的物质的量为 .其中碳原子的物质的量为 .氧原子的物质的量为 , ⑷ 请你仿照上述说说. [小结]微粒数.阿伏加德罗常数(NA)三者的关系: [应用与实践3] ⑴ 判断正误: ① 1mol小米, ② 1mol氢, ③ 0.5mol氧分子和0.5个氧分子, ④ 阿伏加德罗常数就是6.02×1023mol-1. ⑵ 填空: ① 2molCO2中约含 个二氧化碳分子, ② 0.5molH2SO4中约含 个氢原子, ③ 0.25molH2SO4中氧原子的物质的量为 , ④ 6.02×1024个氧分子的物质的量为 , ⑤ 3.01×1023个水分子中氢原子的物质的量为 . ⑶ 你能否体会出:由物质的“物质的量 可求出构成该物质的微粒数和由微粒数求出该物质的物质的量. ⑷ 请你写出下列化学方程式并写出各物质的微粒个数比.物质的量比.物质的质量比: ①碳的完全燃烧,②氢气的燃烧,③甲烷的燃烧.
网址:http://m.1010jiajiao.com/timu3_id_155235[举报]
阿伏加德罗常数的近似值为6.02×1023,下列说法中正确的是
A.BaO2(过氧化钡)固体中的阳离子和阴离子个数比为1:2
B.22.4 L的HCl溶于水,溶液中H+离子数为6.02×1023
C.1 mol CO2与含1mol NaOH的溶液反应后,溶液中 离子数为6.02×1023[
离子数为6.02×1023[
D.Na2O2与H2O反应,常温常压下生成16 gO2,反应中转移电子数为6.02×1023
查看习题详情和答案>>
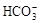 离子数为6.02×1023[
离子数为6.02×1023[