网址:http://m.1010jiajiao.com/timu3_id_155140[举报]
 某化学反应中,设反应物的总能量为E1,生成物的总能量为E2.
某化学反应中,设反应物的总能量为E1,生成物的总能量为E2.
(1)若E1>E2,则该反应为
(2)若E1<E2,则该反应为
(3)太阳能的开发和利用是21世纪的一个重要课题.
①利用储能介质储存太阳能的原理是白天在太阳照射下,某种盐熔化,吸收热量;晚间熔盐释放出相应能量,从而使室温得以调节.已知下列数据:
| 盐 | 熔点/℃ | 熔化吸热/KJ?mol-1 | 参考价格/元?kg-1 |
| CaCL2?6H2O | 29,0 | 37,3 | 780~850 |
| Na2SO4?10H2O | 32,4 | 77,0 | 800~900 |
| Na2HPO4?12H2O | 36,1 | 100,1 | 1600~2000 |
| Na2S2O3?5H2O | 48,5 | 49,7 | 1400~1800 |
A.CaCL2?6H2O B、Na2SO4?10H2O C.Na2HPO4?12H2O D、Na2S2O3?5H2O
②右图是一种太阳能热水器的示意图,图中A是集热器,B是储水容器,C是供阴天时加热的辅助电热器.根据对水的密度的认识,你估计在阳光照射下水将沿
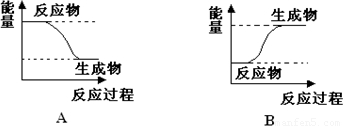
(1)若E1>E2,则该反应为 (填“放热”或“吸热”)反应.该反应可用图 (填“A”或“B”)表示.
(2)若E1<E2,则该反应为 (填“放热”或“吸热”)反应.该反应可用图 (填“A”或“B”)表示.
(3)太阳能的开发和利用是21世纪的一个重要课题.
①利用储能介质储存太阳能的原理是白天在太阳照射下,某种盐熔化,吸收热量;晚间熔盐释放出相应能量,从而使室温得以调节.已知下列数据:
| 盐 | 熔点/℃ | 熔化吸热/KJ?mol-1 | 参考价格/元?kg-1 |
| CaCL2?6H2O | 29,0 | 37,3 | 780~850 |
| Na2SO4?10H2O | 32,4 | 77,0 | 800~900 |
| Na2HPO4?12H2O | 36,1 | 100,1 | 1600~2000 |
| Na2S2O3?5H2O | 48,5 | 49,7 | 1400~1800 |
A.CaCL2?6H2O B、Na2SO4?10H2O C.Na2HPO4?12H2O D、Na2S2O3?5H2O
②右图是一种太阳能热水器的示意图,图中A是集热器,B是储水容器,C是供阴天时加热的辅助电热器.根据对水的密度的认识,你估计在阳光照射下水将沿 (填“顺”或“逆”)时针方向流动.
(1)蕴藏在海底的“可燃冰”是高压下形成的外观酷似冰的甲烷水合物.我国南海海底有丰富的“可燃冰”资源.取365g分子式为CH4?9H2O的“可燃冰”,将其释放的甲烷完全燃烧生成CO2和H2O(l),可放出1780.6kJ的热量,则甲烷燃烧的热化学方程式为

(2)甲醇是重要的基础化工原料,又是一种新型的燃料,制取甲醇的传统方法是采用CuO-ZnO/γ-Al2O3为催化剂,合成反应为:CO+2H2
| ||
| 加热加压 |
最近有人制造了一种燃料电池,一个电极通入空气,另一个电极加入甲醇,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子.该电池的正极反应式为

(1)X的化学式为__________________,O的结构简式为__________________。
(2)考虑到综合经济效益,工业生产M时,可采取的措施有__________________(填序号)。
a.使用催化剂 b.适当降低温度
c.选择合适的温度 d.适度增大压强
e.及时分离出产物 f.对原料进行循环利用
g.充分利用反应本身放出的热量 h.工厂地址尽可能选择在交通发达的城市
i.工厂地址可选择在盛产天然气的地区
(3)设备I的名称__________。工业生产中为了节约资源、降低成本和保护环境,常常对某些物质进行循环利用。上述转化关系中能达到该目的的是__________(填序号)。
(4)现有1 mol A参加反应,假设各步均完全反应,生成N的质量为
研究化学反应原理对于生产生活是很有意义的。
(1)下列关于醋酸的叙述正确的是 (填写符号)。
a.等体积等pH的醋酸和盐酸完全被NaOH溶液中和,消耗NaOH的物质的量一样多
b.向醋酸溶液中加入一定量NaOH固体,溶液的导电性增强
c.加水稀释醋酸溶液,溶液中的所有离子浓度均减小
d.常温下,醋酸溶液中水的电离程度比纯水的小
(2)钢铁生锈现象随处可见,钢铁的电化腐蚀原理如图所示:
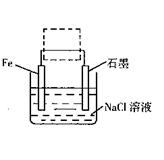
①写出石墨电极的电极反应式 ;
②将该装置作简单修改即可成为钢铁电化学防护的装置,请在右图虚线框内所示位置作出修改。
③写出修改后石墨电极的电极反应式 。
(3)①高炉炼铁过程中会发生反应:FeO(s)+CO(g)![]() Fe(s)+CO2(g)。
Fe(s)+CO2(g)。
已知:Fe(s)+1/2O2(g)=FeO(s)△H= -272kJ·mol-1
C(s)+O2(g)=CO2(g) △H= -393.5kJ·mol-1
2C(s)+O2(g)=2CO(g) △H= -22lkJ·mol-1
则:①FeO(s)+CO(g)![]() Fe(s)+CO2(g)
Fe(s)+CO2(g)
△H= 。
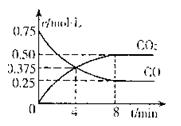
②一定温度下,向某密闭容器中加人足量FeO,
并充人一定量的CO气体,反应过程中CO和CO2的
浓度与时间的关系如图所示则从开始至达到平衡过程中,![]() (CO)= 。
(CO)= 。
(4)铁红是一种红色颜料,其成份是Fe2O3。将一定量的铁红溶于160mL 5mol·L-1盐酸中,再加人一定量铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为 。
查看习题详情和答案>>