摘要:下列说法正确的是( ) A.Na+比Al3+还原性强.Cl-比S2-氧化性强 B.铝既有酸性又有碱性 C.原子的最外电子层上有两个电子的元素一定是金属元素 D.稀有气体元素的原子中各电子层均已达到饱和
网址:http://m.1010jiajiao.com/timu3_id_154936[举报]
大气中的SO2是造成酸雨的主要污染物。最新研究表明,离子晶体[N(CH3)4]2 SO4(s) 能与SO2进行如下可逆反应,使其可能成为绿色的SO2吸收剂:
[N(CH3)4]2 SO4(s)+SO2(g) [N(CH3)4]2
S2O6(s)
[N(CH3)4]2
S2O6(s)
下列说法正确的是
A.[N(CH3)4]+中只含σ键
B.该反应中,SO2作氧化剂
C.SO2漂白品红是利用其强氧化性
D.每吸收标准状况下的SO211.2L,生成15.4g[N(CH3)4]2 S2O6
查看习题详情和答案>>
现有E、F、G、M、N五种可溶的强电解质,它们在水中电离产生下列离子(各种离子不重复)。
|
阳离子 |
H+、Na+、Al3+、Ag+、Ba2+ |
|
阴离子 |
OH-、Cl-、CO32-、NO3-、SO42- |
已知:
①E、F两溶液呈碱性;G、M、N 溶液呈酸性。
②向N溶液中逐滴滴加F溶液至过量,沉淀量先增加后减少但不消失。
③M溶液与另外四种溶液反应都能产生沉淀。
下列说法正确的是
A.N溶液与过量的F溶液反应的离子方程式: Ba2++SO42-=BaSO4↓
B.E溶液与N溶液混合发生反应:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑
C.M溶液与F溶液混合产生的沉淀不能溶解于过量氨水中
D.将G溶液逐滴加入等体积、等物质的量的浓度的E溶液中,反应的离子方程式为
2H++CO32-=CO2↑+H2O
查看习题详情和答案>>
在密闭容器中发生如下反应:mA(g)+nB(g)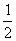 pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的
pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的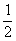 ,当达到新平衡时,C的浓度为原来的1.9倍,下列说法正确的是( )
,当达到新平衡时,C的浓度为原来的1.9倍,下列说法正确的是( )
A.m+n>p B.平衡向逆反应方向移动
C.A的转化率提高 D.C的体积分数增加
查看习题详情和答案>> Ca(OH)2(aq)
Ca(OH)2(aq) Ca(OH)2(aq)
Ca(OH)2(aq)