网址:http://m.1010jiajiao.com/timu3_id_154668[举报]
右表是元素周期表的一部分。(共7分)
(1)表中元素⑩的氢化物的化学式为 ,此氢化物的还原性比元素⑨的氢化物的还原性 (填强或弱)
(2)某元素原子的核外p电子数比s电子数少1,则该元素的元素符号是 ,其单质的电子式为 。
(3)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。写出元素③的氢氧化物与NaOH溶液反应的化学方程式
(2分)
又如表中与元素⑦的性质相似的不同族元素是 (填元素符号)
查看习题详情和答案>>
(16分)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
| a |
|
| |||||||||||||||
| b |
|
|
| c | d | e | f |
| |||||||||
| g | h | i | j |
| k | l | m | ||||||||||
| n |
|
|
|
|
|
| o |
|
|
|
|
|
|
|
|
|
|
试回答下列问题:
(1)请写出元素O的基态原子电子排布式 。
(2)第三周期8种元素按单质熔点高低的顺序如右图,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填图中的序号)。
(3)由j原子跟c原子以1 : 1相互交替结合而形成的晶体,晶型与晶体j相同。两者相比熔点更高的是 (填化学式),试从结构角度加以解释:
。
(4)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
若已知i的原子半径为d,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
①一个晶胞中i原子的数目为_ _;
②该晶体的密度为______ (用字母表示)。
查看习题详情和答案>>
右表是元素周期表的一部分。(共7分)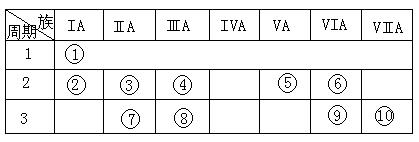
(1)表中元素⑩的氢化物的化学式为 ,此氢化物的还原性比元素⑨的氢化物的还原性 (填强或弱)
(2)某元素原子的核外p电子数比s电子数少1,则该元素的元素符号是 ,其单质的电子式为 。
(3)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。写出元素③的氢氧化物与NaOH溶液反应的化学方程式
(2分)
又如表中与元素⑦的性质相似的不同族元素是 (填元素符号)
(16分)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
| a | | | |||||||||||||||
| b | | | | c | d | e | f | | |||||||||
| g | h | i | j | | k | l | m | ||||||||||
| n | | | | | | | o | | | | | | | | | | |
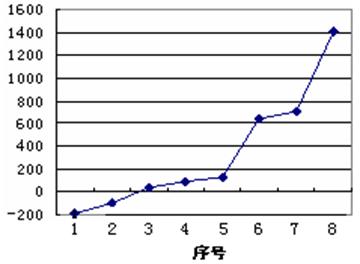
试回答下列问题:
(1)请写出元素O的基态原子电子排布式 。
(2)第三周期8种元素按单质熔点高低的顺序如右图,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填图中的序号)。
(3)由j原子跟c原子以1 : 1相互交替结合而形成的晶体,晶型与晶体j相同。两者相比熔点更高的是 (填化学式),试从结构角度加以解释:
。
(4)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
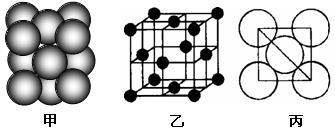
若已知i的原子半径为d,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
①一个晶胞中i原子的数目为_ _;
②该晶体的密度为______ (用字母表示)。 查看习题详情和答案>>
(8分)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
| a | | | |||||||||||||||
| b | | | | c | d | e | f | | |||||||||
| g | h | i | j | | k | l | m | ||||||||||
| n | | | | | | | o | | | | | | | | | | |
(1)请写出元素O的基态原子电子排布式
。
(2)第三周期8种元素按单质熔点高低的顺序如右图,其中序号“8”代表
(填元素符号);其中电负性最大的是 (填右图中的序号)。
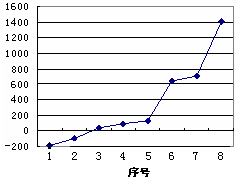
(3)由j原子跟c原子以1 : 1相互交替结合而形成的晶体,晶型与晶体j相同。两者相比熔点更高的是 (填化学式),试从结构角度加以解释:
。 查看习题详情和答案>>