摘要:已知氮.硅原子结构示意图依次为:N .Si . 氮化硅是一种新型陶瓷材料的主要成分.能承受高温.可用于制造业.航天业等.试写出氮化硅的化学式 .医学研究表明:偏硅酸有软化血管的作用.对心脏病.高血压有一定疗效.偏硅酸是二元酸.又是含氧酸.则偏硅酸的化学式为 .
网址:http://m.1010jiajiao.com/timu3_id_154523[举报]
(10分)填空回答:
(1)氮化硅是一种高温陶瓷材料。根据元素周期律知识,写出氮化硅的化学式: 。
(2)有A、B、C、D、E、F六种元素,它们均属短周期元素,其原子序数依次增大,它们两两形成的化合物有以下几种:
| 形成的化合物 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 化合物中各元素的原子个数比 | A:C=1:1 | B:A=1:3 | D:C=1:1 | E:F=1:3 | A:F=1:1 |
① F元素位于周期表中的位置 。
② E元素的原子结构示意图为 ,乙的电子式为 ,丙的电子式为 ,B的最高价氧化物的水化物的化学式为 。
③向甲的水溶液中加入
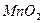 ,反应的化学方程式为 。
查看习题详情和答案>>
,反应的化学方程式为 。
查看习题详情和答案>>
(7分)填空回答:
(1)氮化硅是一种高温陶瓷材料。根据元素周期律知识,写出氮化硅的化学式: 。
(2)有A、B、C、D、E、F六种元素,它们均属短周期元素,其原子序数依次增大,它们两两形成的化合物有以下几种:
| 形成的化合物 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 化合物中各元素的原子个数比 | A:C=2:1 | B:A=1:3 | D:C=1:1 | E:F=1:3 | A:F=1:1 |
① F元素位于周期表中的位置 。
② E元素的原子结构示意图为 ,B的最高价氧化物的水化物的化学式为 。
③向丙物质中滴加甲的化学反应方程式为 。 查看习题详情和答案>>
(7分)填空回答:
(1)氮化硅是一种高温陶瓷材料。根据元素周期律知识,写出氮化硅的化学式: 。
(2)有A、B、C、D、E、F六种元素,它们均属短周期元素,其原子序数依次增大,它们两两形成的化合物有以下几种:
已知A、B两元素的核电荷数之差等于其原子最外层电子数之和;B原子最外层电子数比次外层电子数多3个;C原子的最外层电子数是次外层电子数的3倍;D、E、F同周期,D、A同主族;E与F的原子序数之和为30,丙是离子化合物。回答:
① F元素位于周期表中的位置 。
② E元素的原子结构示意图为 ,B的最高价氧化物的水化物的化学式为 。
③向丙物质中滴加甲的化学反应方程式为 。
(1)氮化硅是一种高温陶瓷材料。根据元素周期律知识,写出氮化硅的化学式: 。
(2)有A、B、C、D、E、F六种元素,它们均属短周期元素,其原子序数依次增大,它们两两形成的化合物有以下几种:
| 形成的化合物 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 化合物中各元素的原子个数比 | A:C=2:1 | B:A=1:3 | D:C=1:1 | E:F=1:3 | A:F=1:1 |
① F元素位于周期表中的位置 。
② E元素的原子结构示意图为 ,B的最高价氧化物的水化物的化学式为 。
③向丙物质中滴加甲的化学反应方程式为 。
(10分)填空回答:
(1)氮化硅是一种高温陶瓷材料。根据元素周期律知识,写出氮化硅的化学式: 。
(2)有A、B、C、D、E、F六种元素,它们均属短周期元素,其原子序数依次增大,它们两两形成的化合物有以下几种:
已知A、B两元素的核电荷数之差等于其原子最外层电子数之和;B原子最外层电子数比次外层电子数多3个;C原子的最外层电子数是次外层电子数的3倍;D、E、F同周期,D、A同主族;E与F的原子序数之和为30,丙是离子化合物。回答:
① F元素位于周期表中的位置 。
② E元素的原子结构示意图为 ,乙的电子式为 ,丙的电子式为 ,B的最高价氧化物的水化物的化学式为 。
③向甲的水溶液中加入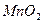 ,反应的化学方程式为 。
,反应的化学方程式为 。
(1)氮化硅是一种高温陶瓷材料。根据元素周期律知识,写出氮化硅的化学式: 。
(2)有A、B、C、D、E、F六种元素,它们均属短周期元素,其原子序数依次增大,它们两两形成的化合物有以下几种:
| 形成的化合物 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 化合物中各元素的原子个数比 | A:C=1:1 | B:A=1:3 | D:C=1:1 | E:F=1:3 | A:F=1:1 |
① F元素位于周期表中的位置 。
② E元素的原子结构示意图为 ,乙的电子式为 ,丙的电子式为 ,B的最高价氧化物的水化物的化学式为 。
③向甲的水溶液中加入
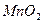 ,反应的化学方程式为 。
,反应的化学方程式为 。(10分)填空回答:
(1)氮化硅是一种高温陶瓷材料。根据元素周期律知识,写出氮化硅的化学式: 。
(2)有A、B、C、D、E、F六种元素,它们均属短周期元素,其原子序数依次增大,它们两两形成的化合物有以下几种:
| 形成的化合物 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 化合物中各元素的原子个数比 | A:C=1:1 | B:A=1:3 | D:C=1:1 | E:F=1:3 | A:F=1:1 |
已知A、B两元素的核电荷数之差等于其原子最外层电子数之和;B原子最外层电子数比次外层电子数多3个;C原子的最外层电子数是次外层电子数的3倍;D、E、F同周期,D、A同主族;E与F的原子序数之和为30,丙是离子化合物。回答:
① F元素位于周期表中的位置 。
② E元素的原子结构示意图为 ,乙的电子式为 ,丙的电子式为 ,B的最高价氧化物的水化物的化学式为 。
③向甲的水溶液中加入,反应的化学方程式为 。
查看习题详情和答案>>