摘要:氢氧化钠.氢氧化钙的化学性质 (1)氢氧化钠的化学性质 1与指示剂反应:其溶液能使石蕊试液变蓝.酚酞试液变红 2与非金属氧化物反应: 2NaOH +CO2=Na2CO3+H2O 2NaOH +SO3=Na2SO4+H2O 3与酸反应: NaOH + HCl = NaCl + H2O 2NaOH+H2SO4=Na2SO4+2H2O 4与某些盐的反应 CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 FeCl3 +3NaOH =Fe(OH)3↓+3NaCl (2)氢氧化钙的化学性质 1与指示剂反应:其溶液能使石蕊试液变蓝.酚酞试液变红 2与非金属氧化物反应:Ca(OH)2+CO2=CaCO3↓+H2O 3与酸反应: Ca(OH)2+2HCl=CaCl2+2H2O Ca(OH)2+H2SO4=CaSO4+2H2O 4与某些盐的反应:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 注意:(1)NaOH必须密封保存.碱液不能存在玻璃瓶塞的试剂瓶中() 2微溶.常温下.NaOH溶液浓度比Ca(OH)2溶液浓度大得多.故实验室用NaOH吸收CO2.而仅用Ca(OH)2溶液检验CO2.
网址:http://m.1010jiajiao.com/timu3_id_15450[举报]
氢氧化钠固体及溶液在空气中很容易发生变质生成碳酸钠.
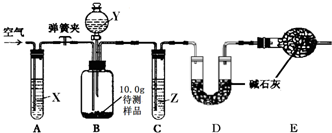
(1)甲同学在实验室里发现一瓶敞口放置的氢氧化钠溶液,对其变质情况进行了如下探究.
【猜想与假设】该氢氧化钠溶液已部分变质.
【实验与结论】
【拓展探究】甲同学又尝试通过实验除去该氢氧化钠溶液中含有的碳酸钠,方案如下:
向该溶液中加入
(2)乙同学在实验室里发现少量部分变质的氢氧化钠固体,尝试通过实验测定其中碳酸钠的质量分数.
【设计和进行实验】乙同学设计了如图所示的实验装置(铁架台、铁夹等固定用装置已略去,碱石灰是固体氢氧化钠和生石灰的混合物).取10.0g待测样品,进行实验.实验步骤如下:
a.连接好装置,并检查气密性;
b.打开弹簧夹,缓缓通入一段时间空气;
c.称量装置D的质量为83.4g;
d.关闭弹簧夹,慢慢滴加Y溶液,至不再产生气泡为止;
e.打开弹簧夹,再次缓缓通入一段时间空气;
f.再次称量装置D的质量为84.5g.
【交流讨论】
①试剂X、Y、Z依次最适宜选用
A.氢氧化钠溶液 浓盐酸 浓硫酸 B.澄清石灰水 稀盐酸 稀硫酸
C.氢氧化钠溶液 稀硫酸 浓硫酸 D.浓硫酸 稀硫酸 氢氧化钠溶液
②步骤e中通入空气的作用是
③若没有装置C,则会导致测定结果
【交流讨论】根据实验中测得的有关数据,计算部分变质的氢氧化钠固体中碳酸钠的质量分数.
查看习题详情和答案>>

(1)甲同学在实验室里发现一瓶敞口放置的氢氧化钠溶液,对其变质情况进行了如下探究.
【猜想与假设】该氢氧化钠溶液已部分变质.
【实验与结论】
| 实验步骤 | 实验现象 | 实验结论 |
| a.取少量该溶液于一支试管中,加入 足量的氯化钙溶液 足量的氯化钙溶液 |
有白色沉淀生成 有白色沉淀生成 |
该氢氧化钠溶液已变质 |
| b.将步骤a所得的液体静置,取上层清液于另一支试管中,滴加 无色酚酞试液 无色酚酞试液 |
酚酞试液变红 酚酞试液变红 |
该氢氧化钠溶液已部分变质 |
向该溶液中加入
氢氧化钙
氢氧化钙
,充分反应后,经过滤
过滤
操作,即可除去该氢氧化钠溶液中含有的杂质.(2)乙同学在实验室里发现少量部分变质的氢氧化钠固体,尝试通过实验测定其中碳酸钠的质量分数.
【设计和进行实验】乙同学设计了如图所示的实验装置(铁架台、铁夹等固定用装置已略去,碱石灰是固体氢氧化钠和生石灰的混合物).取10.0g待测样品,进行实验.实验步骤如下:
a.连接好装置,并检查气密性;
b.打开弹簧夹,缓缓通入一段时间空气;
c.称量装置D的质量为83.4g;
d.关闭弹簧夹,慢慢滴加Y溶液,至不再产生气泡为止;
e.打开弹簧夹,再次缓缓通入一段时间空气;
f.再次称量装置D的质量为84.5g.
【交流讨论】
①试剂X、Y、Z依次最适宜选用
C
C
(选填字母).A.氢氧化钠溶液 浓盐酸 浓硫酸 B.澄清石灰水 稀盐酸 稀硫酸
C.氢氧化钠溶液 稀硫酸 浓硫酸 D.浓硫酸 稀硫酸 氢氧化钠溶液
②步骤e中通入空气的作用是
将B中产生的二氧化碳全部赶到D装置中
将B中产生的二氧化碳全部赶到D装置中
.③若没有装置C,则会导致测定结果
偏大
偏大
(选填“偏大”、“偏小”或“无影响”,下同);若没有装置E,则会导致测定结果偏大
偏大
.【交流讨论】根据实验中测得的有关数据,计算部分变质的氢氧化钠固体中碳酸钠的质量分数.
氢氧化钠固体俗称
查看习题详情和答案>>
烧碱
烧碱
、火碱
火碱
、苛性钠
苛性钠
,在空气中易吸收水分
水分
而潮解,还能吸收二氧化碳
二氧化碳
而变质,所以氢氧化钠必须密封
密封
保存.氢氧化钙俗称熟石灰
熟石灰
、消石灰
消石灰
,它微
微
溶于水,它的饱和溶液是稀
稀
(填“浓”、“稀”)溶液,它的溶解度随温度的升高而降低
降低
.工业上常用生石灰和水反应制得,该反应的化学方程式是CaO+H2O=Ca(OH)2
CaO+H2O=Ca(OH)2
.氢氧化钠和氢氧化钙是实验室常用的试剂,它们在工农业生产上的应用也非常广泛,它们有相似之处,也有不同点:
(1)它们的水溶液都能使无色酚酞变红色,是因为 ;它们都能与酸反应,生成盐和水,像这种碱和酸作用生成盐和水的反应叫做
(2)它们的水溶液都能与二氧化碳反应,实验室吸收反应多余的二氧化碳一般用 (选填氢氧化钠溶液或氢氧化钙溶液),理由是
(3)利用物质与物质间的反应,可以制造出许多新的物质,请写出实验室利用石灰水制取少量氢氧化钠的化学方程式
(4)物质的用途与其性质密切相关,将氢氧化钠和氢氧化钙两种固体分别暴露在空气中,固体 (选填氢氧化钠或氢氧化钙)表面会出现潮湿而逐渐溶解的现象,利用这种性质,该固体可以用作某些气体(如氧气、氢气)的干燥剂.
查看习题详情和答案>>
(1)它们的水溶液都能使无色酚酞变红色,是因为
(2)它们的水溶液都能与二氧化碳反应,实验室吸收反应多余的二氧化碳一般用
(3)利用物质与物质间的反应,可以制造出许多新的物质,请写出实验室利用石灰水制取少量氢氧化钠的化学方程式
(4)物质的用途与其性质密切相关,将氢氧化钠和氢氧化钙两种固体分别暴露在空气中,固体