摘要:有一类化学计算题.由于某一条件的不确定.结果可能是两个或两个以上.也可能在某个范围内取值.这类题就需要用讨论的方法求解.近几年高考中出现的涉及讨论的试题主要有四种类型:①讨论反应发生的程度,②讨论反应物是否过量,③讨论反应物或生成物的组成范围,④讨论不定方程的解. 前三种类型的讨论题一般思路是:①首先利用有关反应方程式确定两种反应物恰好完全作用时.各反应物和生成物的具体的量的关系,②然后再按某一反应物的量不足或过量分别讨论,③最后将①②联系起来找出各种情况下对应的答案或取值范围. 对不定方程的讨论.需充分利用题目中给出的条件.有选择范围地讨论. [难题巧解点拨] 例1 某K2CO3样品中含有Na2CO3.KNO3和Ba(NO3)2三种杂质中的一种或二种.现将13.8g样品加入足量水中.样品全部溶解.再加入过量的CaCl2溶液.得到9g沉淀.对样品所含杂质的正确判断是( ) A.肯定有KNO3 B.肯定有KNO3.可能还含有Na2CO3 C.肯定没有Ba(NO3)2.可能含有KNO3 D.肯定没有Na2CO3和Ba(NO3)2 解析 将13.8g样品加入足量的水.样品全溶解则样品中一定无Ba(NO3)2(因能与K2CO3生成沉淀).下面用极值法分析:如13.8g是纯的K2CO3.则生成CaCO3沉淀应为10g.而现在得沉淀9g.则混进的杂质或不与CaCl2生成沉淀.或13.8g杂质与CaCl2作用生成的沉淀小于9g.杂质中KNO3不与CaCl2生成沉淀.符合题意.而13.8gNa2CO3与CaCl2混合生成沉淀为×100>9g不合理.所以选项A正确.但分析选项B.可能存在这样的情况.即混进很多的KNO3.而只混进少量的Na2CO3.这时也可以保证13.8g样品与CaCl2反应后只生成9g沉淀.故B正确.选项B很容易漏掉.故选A.B. 评析 此题考查学生思维的严密性. 例2 18.4gNaOH和NaHCO3固体混合物.在密闭容器中加热到约250℃.经充分的反应后排出气体.冷却.称得剩余固体质量为16.6g.试计算原混合物中NaOH的百分含量. 解析 解法Ⅰ 混合物加热时的化学方程式为: 2NaHCO3Na2CO3+CO2↑+H2O 2NaOH+CO2 = Na2CO3+H2O 综合为: NaHCO3+NaOHNa2CO3+H2O 84 40 124 106 假设18.4g混合物恰好按84∶40比例混合.设加热后剩余固体为x.则 124∶106=18.4g∶x x=15.7g而实际16.6g.可见NaOH过量.设NaHCO3质量为y,NaOH为18.4g-y NaOH+NaHCO3=Na2CO3+H2O 84 18 y 18.4g-16.6g=1.8g y=8.4g ∴NaOH%=×100%=54.3% 解法Ⅱ 判断混合物中哪种物质过量还可以根据差值法.因为NaOH受热时不分解.所以: NaOH+NaHCO3Na2CO3+H2O 40 84 124 1818.4g x x=2.67g>1.8g.说明NaOH过量. 解法Ⅲ 设混合物由等摩尔比组成.并设形成1.8g差量时消耗混合物的质量为m.则124∶18=m∶1.8g m=12.4g 因为原混合物为18.4g形成1.8g差值只需12.4g.所以余下18.4g-12.4g=6g.这6g不是NaHCO3而是不分解的NaOH.说明NaOH过量.以下解法同上. 评析 许多计算题并不明显给出已知条件.初审时感到条件不足.这时就要仔细分析.挖掘隐含条件.本题的关键是要判断NaOH和NaHCO3在反应时哪一种过量.而题目的条件只是反应前后的固体混合物的质量变化.NaOH与NaHCO3按不同比例混合时.引起的质量减小也不同.再与已知条件相比较.即可判断是哪种物质过量. [典型热点考题] 例1 关于锂的结构和性质的判断.错误的是( ) (1)与水反应比钠剧烈 (2)它的原子半径比钠小 (3)它的氧化物暴露于空气易吸收二氧化碳 (4)它的阳离子最外层电子数和钠的相同 (5)它是还原剂 A.只有 C.和(4) 解析:该题为碱金属元素性质的判断题.解此题的关键是注意对碱金属元素的相似性.差异性和递变性的理解和掌握.(1)钠比锂的金属性强.所以锂与水反应不如钠剧烈.此项说法错误.(2)锂原子的电子层为2层.钠原子有3个电子层.所以前者比后者原子半径小.此项正确.(3)氧化锂与氧化钠相似.也是碱性氧化物.易吸收酸性氧化物二氧化碳变为碳酸盐.(4)锂离子Li+最外层只有2个电子.而钠离子Na+最外层有8个电子.此项说法错误.(5)锂也是活泼金属.它在反应中只能作还原剂.故答案为D. 例2 下列关于钾.钠.铷.铯的叙述中不正确的是( ) A.其氢氧化物中碱性最强的是CsOH B.氧化能力最强的是钠原子 C.原子半径随核电荷数的增大而增大 D.单质的密度均小于1g/cm3 解析:在Na.K.Rb.Cs四种碱金属中.Cs的金属性最强.所以CsOH的碱性最强.A选项正确,钠原子只能失去电子.不能得到电子.即钠原子没有氧化性.B选项错误,核电荷数越大.电子层数越多.原子半径越大.C选项正确,从Na→K→Rb→Cs.碱金属的密度逐渐增大.K.Na的密度小于1g·cm-3.但Rb.Cs的密度大于1g·cm-3.D选项错误. 答案:B.D. 例3 某物质燃烧时.焰色为黄色.下列判断正确的是( ) A.该物质一定是钠的化合物 B.该物质中一定含有钾元素 C.该物质一定是金属钠 D.该物质中一定含有钠元素 解析:所谓焰色就是指一些发光物质.当加热提供其一定的能量时.自身便可发出各种颜色的光.由此看出它的能量转换是提供的能量直接转变成光能.这一点与白炽灯的工作能量转换有着明显的区别.正因为如此.发光物质的研究才是当今的活跃科技领域之一.那么发光物质的发光是由原子产生的.还是由离子产生的呢?请注意下列事实:①路边的照明灯发出光多为黄色.原因是路灯里装入的是纯净的金属钠.当通电后钠汽化.钠原子接受电能并将其转化为光能.从而产生黄光.用这种路灯有两大好处:一是省电.二是光的亮度是同功率白炽灯的几倍至几十倍.②我国每逢重大的庆祝活动或重大的节日.有放焰火的习惯.若放出黄色焰火.则制造焰火的原料必有NaCl.因为Na+产生的焰色是黄色的.由此可以看出:发光物质的颜色既不能断言是离子的.也不能确认是原子的.所以说焰色反应是元素的行为. 答案:D. 例4 将含Na2CO310.6g的Na2CO3溶液100mL逐滴滴加到100g4.56%的盐酸中与将100g4.56%的盐酸逐滴滴加到含Na2CO310.6g的Na2CO3溶液100mL中.两者所产生的气体的质量比是( ) A.1∶1 B.2∶5 C.5∶2 D.2∶1 解析:将Na2CO3加到盐酸中(相对而言.过程中酸过量)与将盐酸加到Na2CO3中(相对而言.过程中Na2CO3过量).两者发生的反应是有区别的. 第一种情况:Na2CO3+2HCl=2NaCl+CO2↑+H2O 第二种情况:HCl+Na2CO3=NaHCO3+NaCl HCl+NaHCO3=NaCl+H2O+CO2↑ 现Na2CO3质量为10.6g.HCl质量为4.56g.在第一种情况下.应按HCl的质量来算产生的CO2的质量.设产生CO2的质量为x: Na2CO3+2HCl=2NaCl+H2O+CO2↑ 73 44
网址:http://m.1010jiajiao.com/timu3_id_154412[举报]
(10分) 地下水中硝酸根离子、亚硝酸根离子会造成地下水污染,目前地下水中硝酸根离子经济可行的脱氮方法是在合适的催化剂作用下,用还原剂(如HCOONa)将硝酸根离子还原为氮气而脱氮。
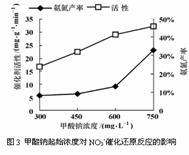
某化学研究性学习小组的同学在技术人员指导下,研究水样中硝酸根起始浓度为100 mg?L- 1条件下,用一定量的催化剂,以甲酸钠进行反硝化脱氮的效率及脱氮的最佳条件,实验中控制起始pH=4.5。经测定得到图1、图2及图3如下。


(1)地下水中硝酸盐可能来源于 ,地下水中硝酸盐含量的增大不仅影响人类和生物体的身体健康,还可能引起 等环境问题。(填一项)
(2)请写出用甲酸钠脱氮的主要离子方程式: 。
(3)分析图1,下列有关说法正确的是( )
A. NO2- 是反应过程中的中间产物
B.NH4+是反应中的一种副产物
C.反应30min后NO3-脱除速率降低,是因为硝酸根离子浓度降低
D.反应进行到75min时,溶液中含氧酸根离子脱除率最高
(4)由图2、图3分析,在本题实验条件下,用甲酸钠进行反硝化脱氮的合适条件:催化剂投入量为 ,甲酸钠起始浓度为 。
(5)根据图1计算,当反应进行至75min时,若NH4+浓度为3.8 mg?L-1,此时水样中氮的脱除效率为 %。(假设实验过程中溶液体积不变,结果保留两位有效数字)
查看习题详情和答案>>