摘要:能 源 热 值 能源价格 电 3.6×106焦耳/千瓦时 0.50元/千瓦时 煤 2.52×107焦耳/千克 0.40元/千克 煤 气 4.68×107焦耳/米3 2.60元/米3 32.随着人们生活水平的不断提高.家庭厨房使用能源的方式的日趋多样化.某市某小区的居民家中有使用电.煤饼和管道煤气等.有关电.管道煤气.煤的热值和价格如右表所示: (1)据调查统计电器设备把电能转化成热能的利用率70%.煤饼炉的热能利用率约20%.管道煤气的热能利用率约40%.仅从取热考虑.请通过计算说明.选用哪一种能源最经济? (2)使用最经济燃料的缺点是什么?
网址:http://m.1010jiajiao.com/timu3_id_154003[举报]
以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取低碳醇的热力学数据:
反应I:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0 kJ?mol-1
反应II:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=-173.6kJ?mol-1
(1)写出由CH3CH2OH+
(2)在一定条件下,对于反应I:在体积恒定的密闭容器中,达到平衡的标志是
a.CO2和CH3OH 浓度相等 b.H2O的百分含量保持不变
c.H2的平均反应速率为0 d.v正(CO2)=3v逆(H2)
e.混合气体的密度不再发生改变 f.混合气体的平均相对分子质量不再发生改变
如果平衡常数K值变大,该反应
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
其他条件恒定,如果想提高CO2的反应速率,可以采取的反应条件是
a、降低温度 b、补充H2 c、移去甲醇 d、加入催化剂
(3)在密闭容器中,对于反应II中,研究员以生产乙醇为研究对象,在5MPa、m=n(H2)/n(CO2)=3时,测得不同温度下平衡体系中各种物质的体积分数(y%)如图1所示,则表示CH3CH2OH体积分数曲线的是
(4)当质量一定时,增大固体催化剂的表面积可提高化学反应速率.如图2是反应:2NO(g)+2CO(g)?2CO2(g)+N2(g) 中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,若催化剂的表面积S1>S2,在图2中画出NO的浓度在T1、S2条件下达到平衡过程中的变化曲线,并注明条件.
查看习题详情和答案>>
反应I:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0 kJ?mol-1
反应II:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=-173.6kJ?mol-1
(1)写出由CH3CH2OH+
H2O
H2O
?2CH3OH的热化学方程式为:CH3CH2OH(g)+H2O(g)=2CH3OH(g);△H=+75.6 kJ?mol-1
CH3CH2OH(g)+H2O(g)=2CH3OH(g);△H=+75.6 kJ?mol-1
.(2)在一定条件下,对于反应I:在体积恒定的密闭容器中,达到平衡的标志是
bf
bf
(填字母)a.CO2和CH3OH 浓度相等 b.H2O的百分含量保持不变
c.H2的平均反应速率为0 d.v正(CO2)=3v逆(H2)
e.混合气体的密度不再发生改变 f.混合气体的平均相对分子质量不再发生改变
如果平衡常数K值变大,该反应
ad
ad
(填字母)a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
其他条件恒定,如果想提高CO2的反应速率,可以采取的反应条件是
bd
bd
(填字母),达到平衡后,想提高H2转化率的是ac
ac
(填字母)a、降低温度 b、补充H2 c、移去甲醇 d、加入催化剂

(3)在密闭容器中,对于反应II中,研究员以生产乙醇为研究对象,在5MPa、m=n(H2)/n(CO2)=3时,测得不同温度下平衡体系中各种物质的体积分数(y%)如图1所示,则表示CH3CH2OH体积分数曲线的是
Ⅰ
Ⅰ
;表示CO2的体积分数曲线的是Ⅲ
Ⅲ
.(4)当质量一定时,增大固体催化剂的表面积可提高化学反应速率.如图2是反应:2NO(g)+2CO(g)?2CO2(g)+N2(g) 中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,若催化剂的表面积S1>S2,在图2中画出NO的浓度在T1、S2条件下达到平衡过程中的变化曲线,并注明条件.
有关化学实验的基本操作中,正确的是( )
①配制240mL一定物质的量浓度的溶液,用250mL的容量瓶
②金属钠不能保存在液态石蜡中
③测定某溶液的pH,步骤是将干燥的试纸浸入待测溶液中,过一会儿取出,并与标准比色卡比较
④中和热测定实验中以环形铜丝搅拌棒代替环形玻璃搅拌棒会使测定值比理论值偏低
⑤浓NaOH溶液溅到皮肤上,应立即用稀硫酸清洗
⑥称量时,将硫酸铜晶体直接放在天平右盘上进行称量
⑦将烧杯、试管直接放在酒精灯上加热.
①配制240mL一定物质的量浓度的溶液,用250mL的容量瓶
②金属钠不能保存在液态石蜡中
③测定某溶液的pH,步骤是将干燥的试纸浸入待测溶液中,过一会儿取出,并与标准比色卡比较
④中和热测定实验中以环形铜丝搅拌棒代替环形玻璃搅拌棒会使测定值比理论值偏低
⑤浓NaOH溶液溅到皮肤上,应立即用稀硫酸清洗
⑥称量时,将硫酸铜晶体直接放在天平右盘上进行称量
⑦将烧杯、试管直接放在酒精灯上加热.
| A、①②③⑥ | B、①④ | C、②③④⑥ | D、③⑤⑥⑦ |
下列表述中正确的是( )
| A、任何能使熵值增大的过程都能自发进行 | B、△H<0,△S>0的化学反应一定能自发进行 | C、已知热化学方程式2SO2(g)+O2(g)?2SO3(g)△H=-QkJ?mol-1(Q>0),则将2mol SO2(g)和1mol O2(g)置于一密闭容器中充分反应后放出Q kJ的热量 | D、稀溶液中1mol NaOH分别和1mol CH3COOH、1molHNO3反应,两者放出的热量一样多 |
工业上由FeS2制H2SO4的转化关系如下:
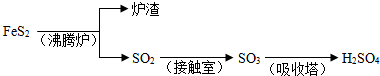
填写下列空白:
(1)已知吸收塔中每40gSO3气体被水完全吸收生成液态硫酸放出65.15kJ,写出该反应的热化学方程式
(2)接触室内发生的反应为:
SO2(g)+
O2(g)
SO3(g)△H=a kJ?mol-1
下表为不同温度(T)下该反应的化学平衡常数(K):
①根据上表数据及化学平衡理论,上述反应中a
②K值越大,表明反应达到平衡时
A.SO2的转化率一定越高 B.SO3的产量一定越大
C.正反应进行得越完全 D.化学反应速率越大
(3)考虑综合经济效益,当炉渣含铁量大于45%时,可用于制硫酸亚铁等.下列利用炉渣里的Fe2O3制FeSO4的方案中,最能体现绿色化学理念的方案是
A.Fe2O3
Fe
FeSO4;B.Fe2O3
Fe2(SO4)3
FeSO4;C.Fe2O3
Fe
FeSO4
(4)为了探究接触室里催化剂颗粒(粗颗粒和细颗粒),反应的温度(673K和723K),反应的压强(101Kpa和1010Kpa)对反应速率的影响,通过变换这些实验条件,至少需要完成
(5)为实现绿色环保、节能减排和废物利用等目的,某硫酸厂用碳酸钙作吸收剂与水配成浆液,洗涤尾气(SO2的体积分数为0.200%)并吸收SO2,得到石膏(CaSO4?2H2O).求:22.4m3(标准状况下)的尾气可制得石膏
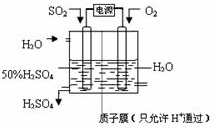
(6)科学家研究出以图所示装置用电化学原理生产硫酸的新工艺,其阳极的电极反应式为
查看习题详情和答案>>

填写下列空白:
(1)已知吸收塔中每40gSO3气体被水完全吸收生成液态硫酸放出65.15kJ,写出该反应的热化学方程式
SO3(g)+H2O(l)=H2SO4(l)△H=-130.3kJ/mol
SO3(g)+H2O(l)=H2SO4(l)△H=-130.3kJ/mol
;(2)接触室内发生的反应为:
SO2(g)+
| 1 |
| 2 |
| ||
| △ |
下表为不同温度(T)下该反应的化学平衡常数(K):
| T/K | 673 | 723 | 823 | 923 |
| K | 423 | 37.4 | 20.5 | 4.68 |
<
<
0(填“>”或“<”);②K值越大,表明反应达到平衡时
C
C
(填标号).A.SO2的转化率一定越高 B.SO3的产量一定越大
C.正反应进行得越完全 D.化学反应速率越大
(3)考虑综合经济效益,当炉渣含铁量大于45%时,可用于制硫酸亚铁等.下列利用炉渣里的Fe2O3制FeSO4的方案中,最能体现绿色化学理念的方案是
B
B
(填标号);A.Fe2O3
| ||
| 高温 |
| 浓硫酸 |
| 浓硫酸 |
| 铁屑 |
| 铁粉 |
| 高温 |
| 浓硫酸 |
(4)为了探究接触室里催化剂颗粒(粗颗粒和细颗粒),反应的温度(673K和723K),反应的压强(101Kpa和1010Kpa)对反应速率的影响,通过变换这些实验条件,至少需要完成
4
4
个实验然后进行对比得出结论;(5)为实现绿色环保、节能减排和废物利用等目的,某硫酸厂用碳酸钙作吸收剂与水配成浆液,洗涤尾气(SO2的体积分数为0.200%)并吸收SO2,得到石膏(CaSO4?2H2O).求:22.4m3(标准状况下)的尾气可制得石膏
0.28
0.28
千克;(取两位有效数字)(设二氧化硫的利用率为80.0% )(6)科学家研究出以图所示装置用电化学原理生产硫酸的新工艺,其阳极的电极反应式为
SO2+2H2O-2e-=SO42-+4H+
SO2+2H2O-2e-=SO42-+4H+
,总反应的化学方程式为2SO2+O2+2H2O=2H2SO4
2SO2+O2+2H2O=2H2SO4
.