网址:http://m.1010jiajiao.com/timu3_id_153759[举报]

(1)将上述反应设计成的原电池如图甲所示,请回答下列问题:
①图中X溶液是
②Cu电极上发生的电极反应式为
③原电池工作时,盐桥中的
(2)将上述反应设计成的电解池如图乙所示,乙烧杯中金属阳离子的物质的量与电子转移的物质的量的变化关系如图丙,请回答下列问题:
①M是
②图丙中的②线是
③当电子转移为2mol时,向乙烧杯中加入
(3)铁的重要化合物高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂,具有很多优点.
①高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O
| ||
②高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为
③Na2FeO4能消毒、净水的原因
(10分)盐酸、硫酸和硝酸是中学阶段常见的三种强酸。请就三者与金属铜的反应情况,回答下列问题:
(1)①在100mL 18mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是
A.40.32L B. 6.72L C.20.16L D.30.24L
②若使上述反应①中剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式 。
(2) 若将过量铜粉与一定量浓硝酸反应,当反应完全停止时,共收集到的气体1.12L(标准状况),则该气体的成分是 ,反应中所消耗的硝酸的物质的量可能为 .
A. 0.25mol B. 0.2mol C.0.15mol D.0.1mol
(3)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解成蓝色溶液,该反应的化学方程式为 。
查看习题详情和答案>>
(10分)盐酸、硫酸和硝酸是中学阶段常见的三种强酸。请就三者与金属铜的反应情况,回答下列问题:
(1)①在100mL 18mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是
A.40.32L B. 6.72L C.20.16L D.30.24L
②若使上述反应①中剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式 。
(2) 若将过量铜粉与一定量浓硝酸反应,当反应完全停止时,共收集到的气体1.12L(标准状况),则该气体的成分是 ,反应中所消耗的硝酸的物质的量可能为 .
A. 0.25mol B. 0.2mol C.0.15mol D.0.1mol
(3) 某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解成蓝色溶液,该反应的化学方程式为 。
某反应中反应物与生成物有:FeCl2、FeCl3、CuCl2、Cu。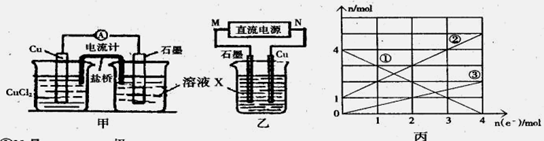
(1)将上述反应设计成的原电池如图甲所示,请回答下列问题:
①图中X溶液是 ;
②Cu电极上发生的电极反应式为 ;
③原电池工作时,盐桥中的 离子(填“K+”或“Cl—”)不断进入X溶液中。
(2)将上述反应设计成的电解池如图乙所示,乙烧杯中金属阳离子的物质的量与电子转移的物质的量的变化关系如图丙,请回答下列问题:
①M是 极;
②图丙中的②线是_______________离子的变化。
③当电子转移为2mol时,向乙烧杯中加入 L 5mol·L-1NaOH溶液才能使所有的金属阳离子沉淀完全。
(3)铁的重要化合物高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂,具有很多优点。
①高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O
 Na2FeO4+3H2↑,则电解时阳极的电极反应式是 。
Na2FeO4+3H2↑,则电解时阳极的电极反应式是 。
②高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为 。
③Na2FeO4能消毒、净水的原因 。
某反应中反应物与生成物有:FeCl2、FeCl3、CuCl2、Cu。
(1)将上述反应设计成的原电池如图甲所示,请回答下列问题:


①图中X溶液是_____________________________;
②石墨电极上发生的电极反应式为__________________________________________;
③原电池工作时,盐桥中的____________(填“K+”或“Cl-”)不断进入X溶液中。
(2)将上述反应设计成的电解池如图乙所示,乙烧杯中金属阳离子的物质的量与电子转移的物质的量的变化关系如图丙,请回答下列问题:
①M是__________极;
②图丙中的②线是______________的变化。
③当电子转移为2 mol时,向乙烧杯中加入________ L 5 mol·L-1 NaOH溶液才能使所有的金属阳离子沉淀完全。
(3)铁的重要化合物高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂,具有很多优点。
①高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O =Na2FeO4+3H2↑,则电解时阳极的电极反应式是__________________________________。
②高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为_______________________________________。
查看习题详情和答案>>