网址:http://m.1010jiajiao.com/timu3_id_152426[举报]
A.将足量的SO2通入棕黄色的FeCl3溶液中,最后溶液变为浅绿色
SO2+2FeCl3+2H2O====2FeCl2+H2SO4+2HCl
B.氯化亚铁溶液在空气中长期放置,会因氧化而产生红褐色浑浊现象
4FeCl2+O2+10H2O====4Fe(OH)3↓+8HCl
C.KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯
3KClO3+6HCl(浓)====3KCl+2ClO2↑+2Cl2↑+3H2O
D.赤铜矿(Cu2O)和辉铜矿(Cu2S)混合加热可得铜
4Cu2O+Cu2S====10Cu+CuSO4
查看习题详情和答案>>Ⅱ.实验室也可用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下:
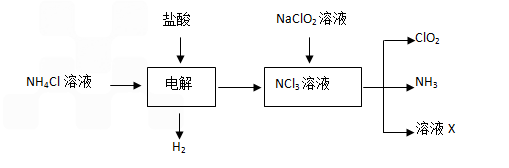
(3)除去ClO2中的NH3可选用的试剂是 ;(填序号)
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.水
(4)测定ClO2(如下图)的过程如下:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用c mol/L硫代硫酸钠标准溶液滴定(I2+2S2O32-=2I-+S4O62-),共用去V mL硫代硫酸钠溶液。
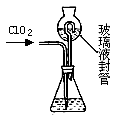
②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式 ______________;
③滴定终点的现象是:___________。
④测得通入ClO2 的质量m(ClO2)= ___________。(用含c、V的代数式表示)
某反应体系中,有反应物和生成物六种物质:HCl(浓)、KClO3、KCl、ClO2、Cl2、H2O。已知该反应中,KClO3发生了一个过程:KClO3→ClO2。ClO2是黄绿色易爆的气体。
(1) 写出并配平上述过程的化学方程式,并标出电子转移的方向和数目。
_____________________________________________________________
(2) 该反应中,盐酸体现了_______、_______性质。氧化剂是___________,反应后,若产生0.6mol气体,则转移电子的物质的量为___________mol。
(3) ClO2是一种广谱型的消毒剂,工业上ClO2常用NaClO3和Na2SO3溶液混合,并加H2SO4反应制得,在以上反应中,NaClO3和Na2SO3的物质的量之比为_________
查看习题详情和答案>>
某反应体系中,有反应物和生成物六种物质:HCl(浓)、KClO3、KCl、ClO2、Cl2、H2O。已知该反应中,KClO3发生了一个过程:KClO3→ClO2。ClO2是黄绿色易爆的气体。
(1) 写出并配平上述过程的化学方程式,并标出电子转移的方向和数目。
_____________________________________________________________
(2) 该反应中,盐酸体现了_______、_______性质。氧化剂是___________,反应后,若产生0.6mol气体,则转移电子的物质的量为___________mol。
(3) ClO2是一种广谱型的消毒剂,工业上ClO2常用NaClO3和Na2SO3溶液混合,并加H2SO4反应制得,在以上反应中,NaClO3和Na2SO3的物质的量之比为_________
查看习题详情和答案>>
某反应体系中,有反应物和生成物六种物质:HCl(浓)、KClO3、KCl、ClO2、Cl2、H2O.已知该反应中,KClO3发生了一个过程:KClO3→ClO2.ClO2是黄绿色易爆的气体.
(1)写出并配平上述过程的化学方程式,并标出电子转移的方向和数目.
________
(2)该反应中,盐酸体现了________、________性质.氧化剂是________,反应后,若产生0.6 mol气体,则转移电子的物质的量为________mol.
(3)ClO2是一种广谱型的消毒剂,工业上ClO2常用NaClO3和Na2SO3溶液混合,并加H2SO4反应制得,在以上反应中,NaClO3和Na2SO3的物质的量之比为________