摘要:23.完成下列离子方程式 (1)CO2+= CO32-+H2O +Ca2++2OH-=CaCO3↓+ (3)(NH4)2SO4溶液与Ba(OH)2溶液混合加热 (4)Cu和AgNO3的溶液
网址:http://m.1010jiajiao.com/timu3_id_151756[举报]
A、B两种化合物的溶液按下图完成实验:

(1)两化合物的化学式:
A_________;B_________。
(2)完成下列离子方程式:
①C→D:____________________________
②F→G:____________________________
查看习题详情和答案>>某短周期元素的原子最外层电子数为次外层的2倍,其单质甲可发生如下反应:
甲+乙(1)若丙为NO2.
①甲与乙反应的化学方程式为________.
②NO2可作火箭重要燃料-肼(N2H4)的助燃剂.已知:
N2(g)+2O2(g)=2NO2(g) ΔH=+67.7 kJ·mol-1,
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ΔH=-1135.7 kJ·mol-1.
写出燃料-肼(N2H4)燃烧生成氮气和水蒸气的热化学方程式:________.
(2)若丙为SO2.
①把乙滴入硫酸铜晶体,观察到的现象是________.
②SO2能使酸性KMnO4溶液紫红色褪去,完成下列离子方程式:
③SO2在一定条件下,发生:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0反应.该反应的化学平衡常数K=________(填表达式);反应达平衡时,若改变其中一个条件x,则符合图中曲线的是________(填序号).
2SO3(g) ΔH<0反应.该反应的化学平衡常数K=________(填表达式);反应达平衡时,若改变其中一个条件x,则符合图中曲线的是________(填序号).
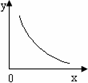
a.x表示温度,y表示SO2的物质的量
b.x表示压强,y表示SO2的转化率
c.x表示SO2的物质的量,y表示O2的物质的量
d.x表示SO3的物质的量,y表示化学平衡常数K
(2013?泰安三模)钛(Ti)具有高强度和耐酸腐蚀性,是重要的工业原料.以金红石(主要成分为TiO2,含少量Fe2O3、SiO2)为原料可制取Ti.工业流程如图1所示:

(1)粗TiC14中含有少量FeCl3、SiCl4等,它们的部分性质如下:
从粗TiC14中精制TiC14的方法是
(2)写出用惰性电极电解熔融NaCl时阳极的电极反应式:
(3)Ti可溶解在浓HF溶液中,请完成下列离子方程式:
+
(4)如图2所示是一个制取氯气并以氯气为原料进行反应的装置.
①装置A中发生反应的化学方程式为
②在实验室中,某同学欲用如图3所示装置净化氯气,则M、N中应盛放的试剂分别是
③实验开始时,先点燃A处的酒精灯,打开旋塞K,让C12充满整个装置,再点燃C处酒精灯.Cl2通过装置M、N再进入装置C,与装置C中的固体粉末发生氧化还原反应生成CO气体.试写出装置C中发生反应的化学方程式:
查看习题详情和答案>>

(1)粗TiC14中含有少量FeCl3、SiCl4等,它们的部分性质如下:
| 物质 | 沸点/℃ | 在水中 | 在乙醚中 |
| TiC14 | 136 | 强烈水解 | 易溶 |
| SiCl4 | 58 | 强烈水解 | 易溶 |
| FeCl3 | 303(升华) | 水解 | 易溶 |
B
B
(填字母).A.用水溶解后,重结晶 B.蒸馏 C.用乙醚萃取后,分液(2)写出用惰性电极电解熔融NaCl时阳极的电极反应式:
2Cl--2e-=Cl2↑
2Cl--2e-=Cl2↑
;阴极产物是钠
钠
.(3)Ti可溶解在浓HF溶液中,请完成下列离子方程式:
1
1
Ti+6
6
HF═1
1
Ti| F | 2- 6 |
2
2
H+
H+
+2
2
H2↑(4)如图2所示是一个制取氯气并以氯气为原料进行反应的装置.
①装置A中发生反应的化学方程式为
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
.
| ||
②在实验室中,某同学欲用如图3所示装置净化氯气,则M、N中应盛放的试剂分别是
饱和食盐水
饱和食盐水
、浓硫酸
浓硫酸
.(填试剂名称)③实验开始时,先点燃A处的酒精灯,打开旋塞K,让C12充满整个装置,再点燃C处酒精灯.Cl2通过装置M、N再进入装置C,与装置C中的固体粉末发生氧化还原反应生成CO气体.试写出装置C中发生反应的化学方程式:
TiO2+2Cl2+2C
TiCl4+2CO
| ||
TiO2+2Cl2+2C
TiCl4+2CO
.
| ||
某短周期元素的原子最外层电子数为次外层的2倍,其单质甲可发生如下反应:甲+乙
丙+丁+水.
(1)若丙为NO2.甲与乙反应的化学方程式为
(2)若丙为SO2.
①把乙滴入硫酸铜晶体,观察到的现象是
②SO2能使酸性KMnO4溶液紫红色褪去,完成下列离子方程式:
查看习题详情和答案>>
| △ |
(1)若丙为NO2.甲与乙反应的化学方程式为
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
| ||
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
.
| ||
(2)若丙为SO2.
①把乙滴入硫酸铜晶体,观察到的现象是
蓝色变为白色
蓝色变为白色
.②SO2能使酸性KMnO4溶液紫红色褪去,完成下列离子方程式:
2
2
MnO4-+5
5
SO2+2
2
H2O=2
2
Mn2++5
5
SO42-+4
4
H+.钛(Ti)具有高强度和耐酸腐蚀性,是重要的工业原料,以金红石(主要成份为TiO2,含有少量Fe2O3、SiO2)为原料可制取Ti.工业流程如下:
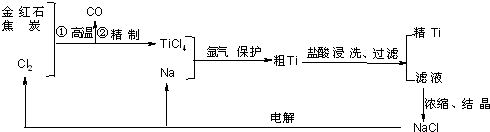
(1)粗TiCl4中含有少量FeCl3、SiCl4等,它们的部分性质如下:
从粗TiCl4 中精制TiCl4 的方法是:
A.用水溶解后,重结晶 B.蒸馏 C.用乙醚萃取后,分液
(2)写出金红石高温反应制取TiCl4 的化学方程式 .
(3)写出电解熔融NaCl的化学方程式 .
(4)粗钛产品粉碎后用盐酸浸洗.其主要目的是 , .
(5)Ti可以溶解在浓HF溶液中,请完成下列离子方程式.
Ti+ HF═ TiF62-+ + H2↑
查看习题详情和答案>>

(1)粗TiCl4中含有少量FeCl3、SiCl4等,它们的部分性质如下:
| 物质 | 沸点/℃ | 在水中 | 在乙醚中 |
| TiCl4 | 136 | 强烈水解 | 易溶 |
| SiCl4 | 58 | 强烈水解 | 易溶 |
| FeCl3 | 303(升华) | 水解 | 易溶 |
A.用水溶解后,重结晶 B.蒸馏 C.用乙醚萃取后,分液
(2)写出金红石高温反应制取TiCl4 的化学方程式
(3)写出电解熔融NaCl的化学方程式
(4)粗钛产品粉碎后用盐酸浸洗.其主要目的是
(5)Ti可以溶解在浓HF溶液中,请完成下列离子方程式.