摘要:1.88g某相对分子质量为117.5的易燃物质可以自身发生爆炸.生成0.432g水.358.4mL氯化氢.448mL和若干克(体积均为标准状况下测定).则此易燃物质的化学式为 .爆炸反应的化学方程式为 .
网址:http://m.1010jiajiao.com/timu3_id_151730[举报]
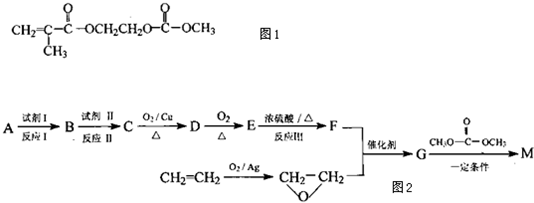
(2013?绵阳模拟)在某锂离子电池中,有一种有机聚合物作为正负极之间锂离子迁移的介质,该有机聚合物的单体之一(用M表示)的结构简式如图1:
用相对分子质量为56的单烯烃A合成M的 方法可设计如图2:
请回答下列问题:
(1)A的结构简式是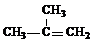
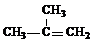 试剂Ⅱ是
试剂Ⅱ是
(2)G在一定条件下反应生成的高聚物是制备隐形眼镜的材料,请写出生成该高聚物的 化学反应方程式
(3)M与足量氯氧化钠溶液反应的化学方程式是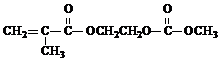 +3NaOH→
+3NaOH→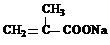 +HOCH2CH2OH+Na2CO3+CH3OH
+HOCH2CH2OH+Na2CO3+CH3OH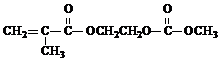 +3NaOH→
+3NaOH→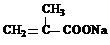 +HOCH2CH2OH+Na2CO3+CH3OH
+HOCH2CH2OH+Na2CO3+CH3OH
(4)在用E制备F的过程中,2分子的E反应会生成一种副产物,其核磁共振氢谱只有 一种吸收峰,该副产物的结构简式为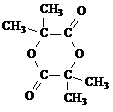
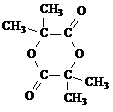 .
.
查看习题详情和答案>>
用相对分子质量为56的单烯烃A合成M的 方法可设计如图2:

请回答下列问题:
(1)A的结构简式是
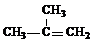
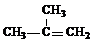
NaOH水溶液
NaOH水溶液
,反应Ⅲ的化学反应类型是消去反应
消去反应
.(2)G在一定条件下反应生成的高聚物是制备隐形眼镜的材料,请写出生成该高聚物的 化学反应方程式
n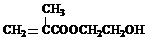
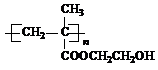
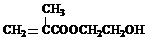
| 一定条件 |
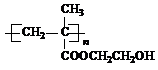
n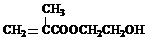
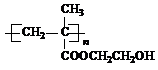
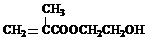
| 一定条件 |
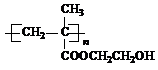
(3)M与足量氯氧化钠溶液反应的化学方程式是
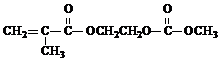 +3NaOH→
+3NaOH→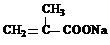 +HOCH2CH2OH+Na2CO3+CH3OH
+HOCH2CH2OH+Na2CO3+CH3OH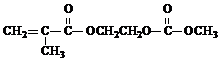 +3NaOH→
+3NaOH→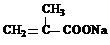 +HOCH2CH2OH+Na2CO3+CH3OH
+HOCH2CH2OH+Na2CO3+CH3OH(4)在用E制备F的过程中,2分子的E反应会生成一种副产物,其核磁共振氢谱只有 一种吸收峰,该副产物的结构简式为
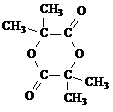
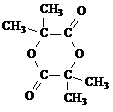
(2013?河东区一模)某相对分子质量为26的烃A,是一种重要的有机化工原料.以A为原料在不同的反应条件下可以转化为烃B、烃C.B和C分子的核磁共振氢谱中都有一个吸收峰.以C为原料通过下列方案可以制备广谱高效食品防腐作用的有机物M,M分子的球棍模型如图所示 .
.

(1)A的结构简式为
 ;
;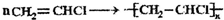
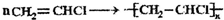 .
.
(2)B能使溴的四氯化碳溶液褪色,则B的结构简式为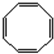
 ,1molB与等物质的量的Br2作用时可能有
,1molB与等物质的量的Br2作用时可能有
(3)C→D的反应类型为
(4)写出E→F的化学方程式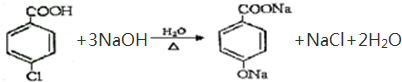
 .
.
(5)G中含氧官能团的名称是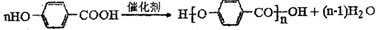
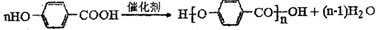 .
.
(6)M的同分异构体有多种,写出两种满足以下条件的同分异构体的结构简式:
①能发生银镜反应
②含有苯环,苯环上有两个侧链且苯环上一氯取代物有两种
③遇FeCl3溶液不显紫色
④1mol该有机物与足量的钠反应生成1mol氢气(一个碳原子上不同时连接两个-OH)
查看习题详情和答案>>
 .
.
(1)A的结构简式为
HC≡CH
HC≡CH
,由A为原料其他无机试剂自选,制备聚氯乙烯的化学方程式为

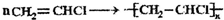
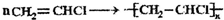
(2)B能使溴的四氯化碳溶液褪色,则B的结构简式为


2
2
种产物.(3)C→D的反应类型为
加成
加成
反应,M的分子式为C9H10O3
C9H10O3
.(4)写出E→F的化学方程式


(5)G中含氧官能团的名称是
羧基和羟基
羧基和羟基
,写出G反应生成高分子物质的化学反应方程式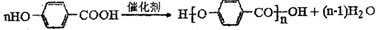
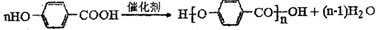
(6)M的同分异构体有多种,写出两种满足以下条件的同分异构体的结构简式:
①能发生银镜反应
②含有苯环,苯环上有两个侧链且苯环上一氯取代物有两种
③遇FeCl3溶液不显紫色
④1mol该有机物与足量的钠反应生成1mol氢气(一个碳原子上不同时连接两个-OH)
 过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等.某化学兴趣小组同学围绕着过氧化氢开展了调查研究与实验.
过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等.某化学兴趣小组同学围绕着过氧化氢开展了调查研究与实验.Ⅰ.调查
(1)通过查阅资料,发现过氧化氢的沸点为152.1℃,而相对分子质量相同的硫化氢的沸点为-60.4℃,造成两者沸点差异大的主要原因是
过氧化氢分子间可以形成分子间氢键,而H2S不能形成氢键
过氧化氢分子间可以形成分子间氢键,而H2S不能形成氢键
;(2)资料显示,过氧化氢制备目前最常用的是乙基蒽醌法,其主要过程可以用如图所示,写出此过程的总反应方程式是
H2+O2
H2O2
| ||
H2+O2
H2O2
.
| ||
Ⅱ.不稳定性实验研究
(3)为了探究温度、催化剂等外界条件对H2O2的分解速率的影响,某兴趣小组同学设计了如下三组实验,部分实验数据已经填在下面表中.
| 实验编号 | T/℃ | H2O2初始浓度/ mol?L-1 |
FeCl3初始浓度/ mol?L-1 |
| Ⅰ | 20 | 1.0 | 0 0 |
| Ⅱ | 50 | 1.0 | 0 |
| Ⅲ | 50 | 1.0 1.0 |
0.1 |
0
0
mol?L-1,实验Ⅱ、Ⅲ研究催化剂对分解速率的影响,则实验Ⅲ中H2O2初始浓度应为1.0
1.0
mol?L-1.②三组实验中分解速率最快的是
Ⅲ
Ⅲ
(填编号).Ⅲ.过氧化氢含量的实验测定
兴趣小组同学用0.1000mol?L-1酸性高锰酸钾标准溶液滴定试样中过氧化氢的含量,反应原理为:2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2
(4)滴定到达终点的现象是
锥形瓶内溶液颜色恰好由无色变为浅紫色,且30秒内溶液不褪色
锥形瓶内溶液颜色恰好由无色变为浅紫色,且30秒内溶液不褪色
.(5)用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗的 KMnO4标准溶液体积如下表所示:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
0.1800
0.1800
mol?L-1.(6)若滴定前尖嘴中有气泡,滴定后消失,则测定结果
偏高
偏高
(“偏高”或“偏低”或“不变”).某相对分子质量为26的烃A,是一种重要的有机化工原料,以A为原料在不同的反应条件下可以转化为烃B、烃C.B、C的氢核磁共振谱显示都只有一种氢,且B分子中碳碳键的键长有两种.以C为原料通过下列方案可以制备具有光谱高效食品防腐作用的有机物M,M分子的球棍模型如图所示.
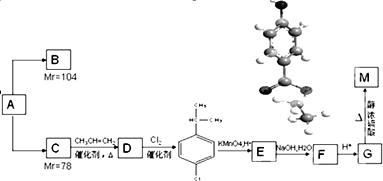
根据上述信息,回答下列问题:
(1)B能使溴的四氯化碳溶液褪色,则B的结构简式为
 ,B与等物质的量Br2作用时可能有
,B与等物质的量Br2作用时可能有
(2)C→D的反应类型为
(3)写出E→F的化学方程式
 .
.
(4)G分子中的含氧官能团的名称是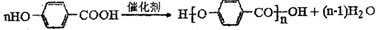
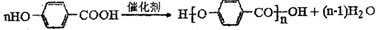 .
.
(5)M的同分异构体有多种,写出满足以下条件的所有同分异构体的结构简式:
①能发生银镜反应②含有苯环且苯环上一氯取代物有两种③遇FeCl3溶液不显紫色④1mol该有机物与足量的钠反应生成1mol氢气(一个碳原子上同时连接两个-OH的结构不稳定)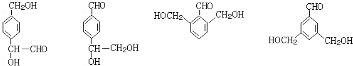
 .
.
查看习题详情和答案>>

根据上述信息,回答下列问题:
(1)B能使溴的四氯化碳溶液褪色,则B的结构简式为


2
2
种产物.(2)C→D的反应类型为
加成反应
加成反应
.(3)写出E→F的化学方程式


(4)G分子中的含氧官能团的名称是
羟基、羧基
羟基、羧基
,写出由G反应生成高分子的化学反应方程式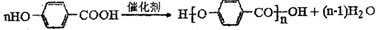
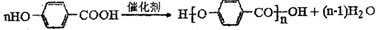
(5)M的同分异构体有多种,写出满足以下条件的所有同分异构体的结构简式:
①能发生银镜反应②含有苯环且苯环上一氯取代物有两种③遇FeCl3溶液不显紫色④1mol该有机物与足量的钠反应生成1mol氢气(一个碳原子上同时连接两个-OH的结构不稳定)

