网址:http://m.1010jiajiao.com/timu3_id_150241[举报]
| ||

试回答下列问题:
(1)请在上图(右上装置中)选择满足实线框图I的气体发生装置:
(2)实验装置Ⅲ的作用是
(3)一段时间后,装置Ⅲ的溶液仍呈强碱性,其中肯定存在Cl-、OH-和SO42-,请设计实验探究该吸收液中可能存在的其它阴离子(不考虑空气中CO2的影响).
①提出合理假设:假设1:只存在SO32-; 假设2:只存在ClO-; 假设3:
②设计实验方案进行实验,请写出实验步骤以及预期现象和结论.实验试剂:3mol?L-1 H2SO4、1mol?L-1 NaOH、0.01mol?L-1 KMnO4、淀粉KI溶液、紫色石蕊试液.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3mol?L-1 H2SO4至溶液显酸性,然后将所得溶液分置于A、B试管中. | / |
| 步骤2: | |
| 步骤3: |
某校化学兴趣小组的同学利用漂白粉与稀硫酸在加热条件下反应制取Cl2,其反应的化学方程式为:Ca(ClO)2+CaCl2+2H2SO4 2CaSO4+2Cl2↑+2H2O.以下是制取CI2并验证其部分性质的实验装置.
2CaSO4+2Cl2↑+2H2O.以下是制取CI2并验证其部分性质的实验装置.

试回答下列问题:
(1)请在上图(右上装置中)选择满足实线框图I的气体发生装置:______(填代号);
(2)实验装置Ⅲ的作用是______;
(3)一段时间后,装置Ⅲ的溶液仍呈强碱性,其中肯定存在Cl-、OH-和SO42-,请设计实验探究该吸收液中可能存在的其它阴离子(不考虑空气中CO2的影响).
①提出合理假设:假设1:只存在SO32-; 假设2:只存在ClO-; 假设3:______
②设计实验方案进行实验,请写出实验步骤以及预期现象和结论.实验试剂:3mol?L-1 H2S〇4、1mol?L-1 NaOH、O.O1mol?L-1 KMn〇4、淀粉KI溶液、紫色石蕊试液.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3mol?L-1 H2SO4至溶液显酸性,然后将所得溶液分置于A、B试管中. | |
| 步骤2: | |
| 步骤3: |
| ||

试回答下列问题:
(1)请在上图(右上装置中)选择满足实线框图I的气体发生装置:______(填代号);
(2)实验装置Ⅲ的作用是______;
(3)一段时间后,装置Ⅲ的溶液仍呈强碱性,其中肯定存在Cl-、OH-和SO42-,请设计实验探究该吸收液中可能存在的其它阴离子(不考虑空气中CO2的影响).
①提出合理假设:假设1:只存在SO32-; 假设2:只存在ClO-; 假设3:______
②设计实验方案进行实验,请写出实验步骤以及预期现象和结论.实验试剂:3mol?L-1 H2SO4、1mol?L-1 NaOH、0.01mol?L-1 KMnO4、淀粉KI溶液、紫色石蕊试液.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3mol?L-1 H2SO4至溶液显酸性,然后将所得溶液分置于A、B试管中. | / |
| 步骤2:______ | ______ |
| 步骤3:______ | ______ |
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表:
| 实 验 步 骤 | 现 象 | 结 论 |
| ①分别取等体积的2 mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 | 反应快慢: Mg>Fe>Cu | 反应物的性质越活泼,反应速率越快。 |
(1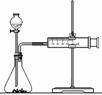 )该同学的实验目的是________________________________;
)该同学的实验目的是________________________________;
要得出正确的实验结论,还需控制的实验条件是________。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用右图
装置进行定量实验。完成该实验应选用的实验药品是______;
应该测定的实验数据是____________________________。
实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是__________________的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是____
A、硫酸钾 B、硫酸锰 C、氯化锰 D、水
查看习题详情和答案>>影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表:
| 实 验 步 骤 | 现 象 | 结 论 |
| ①分别取等体积的2 mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 | 反应快慢: Mg>Fe>Cu | 反应物的性质越活泼, 反应速率越快。 |
 (1)该同学的实验目的是 ;
(1)该同学的实验目的是 ;
要得出正确的实验结论,还需控制的实验条件是 。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用右图装置进行定量实验。完成该实验应选用的实验药品可以是(从题中所给药品中挑选)
;
实验二:
已知: 2KMnO4+5H2C2O4+3H2SO4 = K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是_______________的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是 。
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水
查看习题详情和答案>>