摘要:某温度时.在2L容器中X.Y.Z三种物质随时间的变化关系曲线如图所示. (1) 由图中的数据分析.该反应的化学方 程式为 , (2) 反应开始至2min.5min时Z的平 均反应速率分别为 . , (3)若10℃时测得反应速率VX=0.3 mol·L-1·s-1 50℃时反应速率VY =25.6 mol·L-1·s-1.则温度每升高10℃.该反应速率增至原来的 倍 A.3倍 B.4倍 C.16倍 D.85倍 2005~2006学年度第二学期期中测试
网址:http://m.1010jiajiao.com/timu3_id_150115[举报]
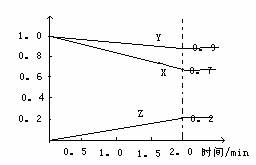
 某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示.
某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示.(1)由图中的数据分析,该反应的化学方程式为
3X+Y?2Z
3X+Y?2Z
(2)反应开始至2min、5min时Z的平均反应速率为
0.05mol?(L?min)-1
0.05mol?(L?min)-1
、0.04mol?(L?min)-1
0.04mol?(L?min)-1
.(3)反应开始至2min、5min时Z的平均反应速率
反应开始至2min时Z的平均速率较大
反应开始至2min时Z的平均速率较大
(填“大”、“小”或“相等”). 某温度时,在2L容器中X、Y、Z三种物质随时间的变化曲线如图所示,
某温度时,在2L容器中X、Y、Z三种物质随时间的变化曲线如图所示,(1)图中的数据分析,该反应的化学方程式为
3X+Y 2Z
2Z
 2Z
2Z3X+Y 2Z
2Z
,反应开始至2min时Z的平均反应速率为 2Z
2Z0.05mol/(L?min)
0.05mol/(L?min)
,若X、Y、Z均为气体,则反应0时刻与2min时容器中气体压强之比为10:9
10:9
.(2)下列表示该反应速率最快的是
B
B
A.V(X)=0.6mol/(L?s)B.V(Y)=0.3mol/(L?s)C.V(Z)=0.5mol/(L?s)
(3)若X、Y、Z均为气体,下列说法不正确的是
B
B
A.升高温度,则X的消耗速率会变快
B.容积不变时向容器中充入He,气体的压强变大,反应速率变大
C.增大Y的浓度,X的消耗速率会变快
D.加入催化剂后,反应会加快.
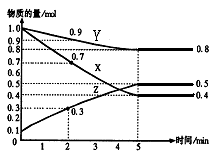
 某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.由图中数据分析:
某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.由图中数据分析: 2Z
2Z