网址:http://m.1010jiajiao.com/timu3_id_149542[举报]
|
已知一种c(H+)=1×10-3 mol/L的一元酸溶液和一种c(OH-)=1×10-3 mol/L的一元碱溶液等体积混合后溶液呈碱性,生成的盐是 | |
| [ ] | |
A. |
强酸强碱盐 |
B. |
强酸弱碱盐 |
C. |
强碱弱酸盐 |
D. |
上述三种盐均可能 |
已知25℃时部分弱电解质的电离平衡常数数据如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol·L-1的四种溶液;
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由小到大排列的顺序是_______________(用编号填写)。
(2)常温下,0.1mol·L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是 。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
D.c(OH-)/c(H+) E.c(H+)·c(CH3COO-)/c(CH3COOH)
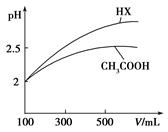
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数_____(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是_____________________。
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中
c(CH3COO-)-c(Na+)= mol·L-1(填精确值)。
(5)标准状况下,将1.12L CO2通入100mL 1mol·L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:
①c (OH-)=2c(H2CO3)+ ;
②c(H+)+c(Na+)= 。 查看习题详情和答案>>
已知短周期主族元素X、Y、Z、W,原子序数依次增大且X和Y的原子序数之和等于Z的原子序数,X和Z可形成X2Z,X2Z2两种化合物,W是短周期主族元素中半径最大的元素.
(1)W在周期表中的位置:________.
(2)在一定条件下,容积为1 L密闭容器中加入1.2 mol X2和0.4 mol Y2,发生如下反应:3X2(g)+Y2(g)![]() 2YX3(g) ΔH反应各物质的量浓度随时间变化如下:
2YX3(g) ΔH反应各物质的量浓度随时间变化如下:
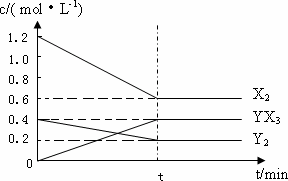
①此反应的平衡常数表达式为________(用化学式表示),K=________.
②若升高温度平衡常数K减小,则ΔH________0(填>,<).
(3)A1是四种元素中三种元素组成的电解质,溶液呈碱性,将0.1 mol·L-1的A1溶液稀释至原体积的10倍后溶液的pH=12,则A1的电子式为________.
(4)B1、B2是由四种元素三种形成的强电解质,且溶液呈酸性,相同浓度时B1溶液中水的电离程度小于B2溶液中水的电离程度,其原因是________.
(5)A2和B1反应生成B2,则0.2 mol/L A2和0.1 mol/L B1等体积混合后溶液中离子浓度大小关系为________.
已知短周期主族元素X、Y、Z、W,原子序数依次增大且X和Y的原子序数之和等于Z的原子序数,X和Z可形成X2Z,X2Z2两种化合物,W是短周期主族元素中半径最大的元素.
(1)W在周期表中的位置:________.
(2)在一定条件下,容积为1 L密闭容器中加入1.2 mol X2和0.4 mol Y2,发生如下反应:
3X2(g)+Y2(g)![]() 2YX3(g) ΔH
2YX3(g) ΔH
反应各物质的量浓度随时间变化如下:

①计算该温度下此反应的平衡常数K=________.
②若升高温度平衡常数K减小,则ΔH________0(填“>”、“<”或“=”).
③改变下列条件,能使该平衡向正反应方向移动且平衡常数不变的是________(填字母).
a.增大压强
b.降低温度
c.使用催化剂
d.增大反应物的浓度
(3)常见液态化合物X2Z2的稀溶液易被催化分解,可使用的催化剂为________(填字母).
a.MnO2
b.FeCl3
c.Na2SO3
d.KMnO4
(4)A是四种元素中三种元素组成的电解质,溶液呈碱性,将常温下0.1 mol·L-1的A溶液稀释至原体积的10倍后溶液的pH=12,则A的电子式为________.
(5)以X2为燃料可制成燃料电池.已知:2X2(g)+Z2(g)=2X2Z(l) ΔH=?572 KJ·mol-1
该燃料电池释放228.8 KJ电能时,生成1 mol液态X2Z,该电池的能量转化率为________.