摘要:13.过氧化钠与足量NaHCO3的混合后.在密闭容器中充分加热.排除气体物质后冷却.残留的是 A. Na2CO3和Na2O2 B. Na2CO3和NaOH C. Na2CO3 D. Na2O.Na2O2和Na2CO3
网址:http://m.1010jiajiao.com/timu3_id_149014[举报]
过氧化钠与足量的NaHCO3混合后,在密闭容器中充分加热,排除气体物质后冷却,残留的是( )。
A.Na2CO3和Na2O2 B.只有Na2CO3
C.Na2CO3和NaOH D.Na2O和NaHCO3 查看习题详情和答案>>
A.Na2CO3和Na2O2 B.只有Na2CO3
C.Na2CO3和NaOH D.Na2O和NaHCO3 查看习题详情和答案>>
过氧化钠与足量的NaHCO3混合后,在密闭容器中充分加热,排除气体物质后冷却,残留的固体物质是
[ ]
A.Na2O2,Na2CO3
B.Na2CO3
C.Na2CO3,NaOH
D.Na2CO3,Na2O2,NaOH
过氧化钠与足量的NaHCO3混合后,在密闭容器中充分加热,排除气体物质后冷却,残留的是
[ ]
A.Na2CO3和Na2O2
B.只有Na2CO3
C.Na2CO3和NaOH
D.Na2O和NaHCO3
Ⅰ、铜器长期暴露在潮湿空气中,它的表层往往含有“铜绿”(碱式碳酸铜),它受热易分解,为了从铜绿中制得铜,并测定铜绿在混合物中的质量分数,把铜绿样品放在试管中,与通入的纯净氢气在加热条件下发生反应,实验装置如图1,请回答下列有关问题.
(1)A处应选用图2装置中的(填写编号)
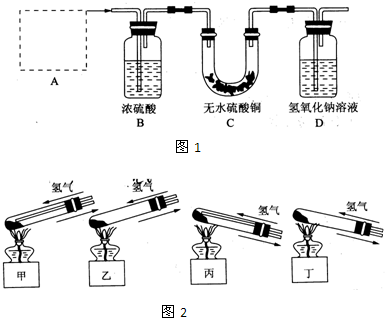
(2)反应开始前,对整个实验装置必须进行的操作是称量样品质量、检查装置的气密性和
(3)要测定铜绿在混合物中的质量分数,除需要知道样品质量外还需测定的实验数据是实验前后装置D质量.
(4)为使实验更准确,可采取的措施是
Ⅱ、10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化
甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为
(1)只要在加热煮沸后的溶液中加入足量的试剂X,若产生沉淀,则
A.Ba(OH)2溶液 B.BaC12溶液 C.NaOH溶液 D.澄清的石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则
(3)查阅资料,发现NaHCO3的分解温度为150℃,丙断言
查看习题详情和答案>>
(1)A处应选用图2装置中的(填写编号)
丙
丙
(铁架台已省去),选用的理由是①因反应有水生成,试管口应略低于试管底部,防止冷凝水倒流到试管底部而使试管炸裂
因反应有水生成,试管口应略低于试管底部,防止冷凝水倒流到试管底部而使试管炸裂
;②通入氢气的导气管应伸入到试管底部,有利于将试管中的空气排净.
(2)反应开始前,对整个实验装置必须进行的操作是称量样品质量、检查装置的气密性和
称量装置D(含氢氧化钠溶液)的质量
称量装置D(含氢氧化钠溶液)的质量
;反应进行时,应先通氢气
通氢气
再加热
加热
;实验过程中,观察到试管中固体颜色变化为固体由绿色变黑色,最后变成光亮的红色
固体由绿色变黑色,最后变成光亮的红色
.(3)要测定铜绿在混合物中的质量分数,除需要知道样品质量外还需测定的实验数据是实验前后装置D质量.
(4)为使实验更准确,可采取的措施是
在D装置后加一个盛有碱石灰的球形干燥管
在D装置后加一个盛有碱石灰的球形干燥管
.Ⅱ、10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
HCO3-+H2O?H2CO3+OH-
HCO3-+H2O?H2CO3+OH-
.乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度大于
大于
(填“大小”或“小于”)NaHCO3.丙同学认为甲、乙的判断都不充分.丙认为:(1)只要在加热煮沸后的溶液中加入足量的试剂X,若产生沉淀,则
乙
乙
(填“甲”或“乙”)判断正确.试剂X是B
B
(填序号).A.Ba(OH)2溶液 B.BaC12溶液 C.NaOH溶液 D.澄清的石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则
甲
甲
(填“甲”或“乙”)判断正确.(3)查阅资料,发现NaHCO3的分解温度为150℃,丙断言
乙
乙
(填“甲”或“乙”)判断是错误的,理由是常压下加热NaHCO3的水溶液,溶液的温度达不到150℃
常压下加热NaHCO3的水溶液,溶液的温度达不到150℃
.