摘要:根据反应:Fe+CuSO4=FeSO4+Cu和Cu+2AgNO3=Cu(NO3)2+2Ag.判断三种金属的还原性由强到弱的顺序是 ,阳离子的氧化性由强到弱的顺序是 .
网址:http://m.1010jiajiao.com/timu3_id_148839[举报]
(8分)请根据反应:Fe + Cu2+ = Fe 2++ Cu 设计原电池:
(1) (2分)画出实验的简易装置图:(用铅笔画图)
(2)(6分)写出电极反应式,正极: ,负极: 。当反应进行到一段时间后取出电极材料,测得某一电极增重了6.4g,则反应共转移了的电子数是 。
(8分)请根据反应 :Fe + Cu2+ = Fe 2++Cu 设计原电池:
(1) (2分)画出实验的简易装置图:(用铅笔画图)
(2)(6分)写出电极反应式,正极: ,负极: 。当反应进行到一段时间后取出电极材料,测得某一电极增重了6.4g,则反应共转移了的电子数是 。
查看习题详情和答案>>
(8分)请根据反应 :Fe + Cu2+ = Fe 2++ Cu 设计原电池:
(1) (2分)画出实验的简易装置图:(用铅笔画图)
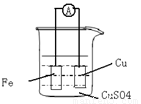
(2)(6分)写出电极反应式,正极: ,负极: 。当反应进行到一段时间后取出电极材料,测得某一电极增重了6.4g,则反应共转移了的电子数是 。
查看习题详情和答案>>
I.下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分 别如下表所示:
请回答
(1)反应①是 (填“吸热”或“放热”)反应.
(2)写出反应③的平衡常数K3的表达式 .
(3)根据反应①与②可推导出K1,K2与K3之间的关系,则K3= (用K1、K2表示).
(4)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有 (填写字母序号).
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.设法减小平衡体系中C0的浓度
II.氯气是工业生产中的重要原料,含氯消毒剂在生活中有着广泛的用途.
(1)工业生产通过电解饱和食盐水获取大量氯气,化学方程式为 .
(2)氯气可用于制取84消毒液(有效成分为NaClO),离子方程式为 .
(3)氯气与氢氧化钠溶液反应,若所得溶液恰好为中性,则溶液中离子浓 度关系正确的是 .
A.c(Na+ )+c(H+ )=c(0H-)+c(Cl-)
B.c(Na+ )=c(ClO- )+c(Cl-)
C.c(Cl-)=c(ClO?)+c(HClO)
D.c(Na+)=2c(ClO- )+c(HClO)
(4)若用钢铁(含Fe、C)制品盛装84消毒液,则易发生电化学腐蚀,钢铁 制品表面生成红褐色沉淀,且84消毒液会失去杀菌消毒的功效.正极反应式为 .
查看习题详情和答案>>
| 化学反应 | 平衡常数 | 温度 | 973K | 1173K | ①Fe(s)+CO2(g)?FeO(s)+CO(g) | K1 | 1.47 | 2.15 | ②Fe(s)+H2O(g)?FeO(s)+H2(g) | K2 | 2.38 | 1.67 | ③CO(g)+H2O(g)?CO2(g)+H2(g) | K3 | ? | ? |
(1)反应①是
(2)写出反应③的平衡常数K3的表达式
(3)根据反应①与②可推导出K1,K2与K3之间的关系,则K3=
(4)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.设法减小平衡体系中C0的浓度
II.氯气是工业生产中的重要原料,含氯消毒剂在生活中有着广泛的用途.
(1)工业生产通过电解饱和食盐水获取大量氯气,化学方程式为
(2)氯气可用于制取84消毒液(有效成分为NaClO),离子方程式为
(3)氯气与氢氧化钠溶液反应,若所得溶液恰好为中性,则溶液中离子浓 度关系正确的是
A.c(Na+ )+c(H+ )=c(0H-)+c(Cl-)
B.c(Na+ )=c(ClO- )+c(Cl-)
C.c(Cl-)=c(ClO?)+c(HClO)
D.c(Na+)=2c(ClO- )+c(HClO)
(4)若用钢铁(含Fe、C)制品盛装84消毒液,则易发生电化学腐蚀,钢铁 制品表面生成红褐色沉淀,且84消毒液会失去杀菌消毒的功效.正极反应式为
下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如表所示:请回答:
(1)反应①是
(2)写出反应③的平衡常数K3的表达式
.
(3)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=
(用K1、K2表示).
(4)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有
A.缩小反应容器的容积 B.扩大反应容器的容积 C.升高温度
D.使用合适的催化剂 E.设法减小平衡体系中的CO的浓度
(5)若反应③的逆反应速率与时间的关系如图所示:

①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:t2时
②若t4时降压,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线.
查看习题详情和答案>>
| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1173K | ||
| ①Fe(s)+CO2(g)?FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g)?FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
| ③CO(g)+H2O(g)?CO2(g)+H2(g) | K3 | ? | ? |
吸热
吸热
(填“吸热”或“放热”)反应.(2)写出反应③的平衡常数K3的表达式
| C(CO2).C(H2) |
| C(CO).C(H2) |
| C(CO2).C(H2) |
| C(CO).C(H2) |
(3)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=
| K2 |
| K1 |
| K2 |
| K1 |
(4)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有
CE
CE
(填写字母序号).A.缩小反应容器的容积 B.扩大反应容器的容积 C.升高温度
D.使用合适的催化剂 E.设法减小平衡体系中的CO的浓度
(5)若反应③的逆反应速率与时间的关系如图所示:

①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:t2时
增大生成物浓度或升高温度
增大生成物浓度或升高温度
; t8时增大压强或使用催化剂
增大压强或使用催化剂
.②若t4时降压,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线.