网址:http://m.1010jiajiao.com/timu3_id_148761[举报]
亚硝酸钠(NaNO2)是重要的防腐剂。某化学兴趣小组尝试制备亚硝酸钠,查阅资料:①HNO2为弱酸,在酸性溶液中,NO2-可将MnO4-还原为Mn2+且无气体生成。
②NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
探究一 亚硝酸钠固体的制备
以碳和浓硝酸为起始原料,设计如下装置利用一氧化氮与过氧化钠反应制备亚硝酸钠。(反应方程式为2NO+Na2O2=2NaNO2,部分夹持装置和A中加热装置已略)

(1)写出装置A烧瓶中发生反应的化学方程式 。
(2)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为排除干扰应在B、C装置间增加装置E,E中盛放的试剂应是 (填字母)。
A.浓H2SO4 B.碱石灰 C.无水CaCl2
探究二 亚硝酸钠固体含量的测定及性质验证
称取装置C中反应后的固体4.000g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000
mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
|
滴定次数 |
1 |
2 |
3 |
4 |
|
KMnO4溶液体积/mL |
20.60 |
20.02 |
20.00 |
19.98 |
(3)第一组实验数据出现异常,造成这种异常的原因可能是 (填字母)。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
(4)根据表中数据,计算所得固体中亚硝酸钠的质量分数 。
(5)亚硝酸钠易溶于水,将0.2mol·L-1的亚硝酸钠溶液和0.1mol·L-1的盐酸等体积混合,混合后溶液呈酸性,则混合后溶液中离子浓度由大到小的顺序为 。
探究三 反应废液的处理
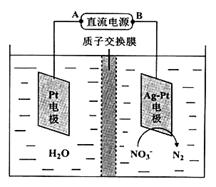
反应后烧瓶A中仍然存在一定量的硝酸,不能直接排放,用NaOH溶液调成中性,再用电化学降解法进行处理。25℃时,反应进行10min,溶液的pH由7变为12。电化学降解NO3-的原理如右图所示。
(6)电源正极为 (填A或B),阴极反应式为 。

查看习题详情和答案>>
亚硝酸钠(NaNO2)是重要的防腐剂。某化学兴趣小组尝试制备亚硝酸钠,查阅资料:①HNO2为弱酸,在酸性溶液中,NO2-可将MnO4-还原为Mn2+且无气体生成。
②NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
探究一 亚硝酸钠固体的制备
以碳和浓硝酸为起始原料,设计如下装置利用一氧化氮与过氧化钠反应制备亚硝酸钠。(反应方程式为2NO+Na2O2=2NaNO2,部分夹持装置和A中加热装置已略)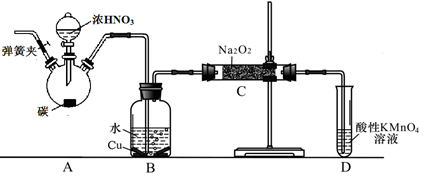
(1)写出装置A烧瓶中发生反应的化学方程式 。
(2)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为排除干扰应在B、C装置间增加装置E,E中盛放的试剂应是 (填字母)。
A.浓H2SO4 B.碱石灰 C.无水CaCl2
探究二 亚硝酸钠固体含量的测定及性质验证
称取装置C中反应后的固体4.000g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000
mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
(3)第一组实验数据出现异常,造成这种异常的原因可能是 (填字母)。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
(4)根据表中数据,计算所得固体中亚硝酸钠的质量分数 。
(5)亚硝酸钠易溶于水,将0.2mol·L-1的亚硝酸钠溶液和0.1mol·L-1的盐酸等体积混合,混合后溶液呈酸性,则混合后溶液中离子浓度由大到小的顺序为 。
探究三 反应废液的处理
反应后烧瓶A中仍然存在一定量的硝酸,不能直接排放,用NaOH溶液调成中性,再用电化学降解法进行处理。25℃时,反应进行10min,溶液的pH由7变为12。电化学降解NO3-的原理如右图所示。
(6)电源正极为 (填A或B),阴极反应式为 。
 查看习题详情和答案>>
查看习题详情和答案>>
②NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
探究一 亚硝酸钠固体的制备
以碳和浓硝酸为起始原料,设计如下装置利用一氧化氮与过氧化钠反应制备亚硝酸钠。(反应方程式为2NO+Na2O2=2NaNO2,部分夹持装置和A中加热装置已略)
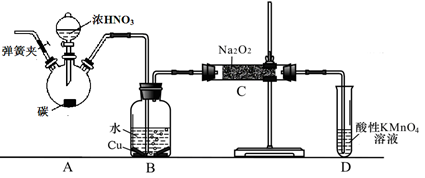
(1)写出装置A烧瓶中发生反应的化学方程式 。
(2)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为排除干扰应在B、C装置间增加装置E,E中盛放的试剂应是 (填字母)。
A.浓H2SO4 B.碱石灰 C.无水CaCl2
探究二 亚硝酸钠固体含量的测定及性质验证
称取装置C中反应后的固体4.000g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000
mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
(3)第一组实验数据出现异常,造成这种异常的原因可能是 (填字母)。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
(4)根据表中数据,计算所得固体中亚硝酸钠的质量分数 。
(5)亚硝酸钠易溶于水,将0.2mol·L-1的亚硝酸钠溶液和0.1mol·L-1的盐酸等体积混合,混合后溶液呈酸性,则混合后溶液中离子浓度由大到小的顺序为 。
探究三 反应废液的处理
反应后烧瓶A中仍然存在一定量的硝酸,不能直接排放,用NaOH溶液调成中性,再用电化学降解法进行处理。25℃时,反应进行10min,溶液的pH由7变为12。电化学降解NO3-的原理如右图所示。
(6)电源正极为 (填A或B),阴极反应式为 。
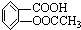 (相对分子质量为180).
(相对分子质量为180).已知:阿司匹林药片中一般添加少量的辅料(都不溶于水,也不与NaOH反应);某课外学习小组为检验阿司匹林有效成分中的官能团并测定乙酰水杨酸在药片中的含量,进行了如下实验:
(1)用氢氧化钠固体配制250mL 0.10mol/L氢氧化钠溶液,完成有关填空.
a.计算所需氢氧化钠的质量;
b.向烧杯中加入适量水,搅拌、使其溶解;
c.用水洗涤烧杯、玻璃棒,洗液注入容量瓶;
d.在托盘天平上通过烧杯称量
e.盖好瓶塞,上下颠倒、摇匀;
f.冷却,将溶液移入250mL容量瓶中;
g.加水至距刻度线1-2cm处改用胶头滴管定容;
h.装瓶、贴上标签、备用
用字母表示正确的配制步骤(只填字母):
(2)配制250mL 0.10mol/L盐酸溶液;
(3)取阿司匹林药片于
(4)用碱式滴定管取25.00mL 0.10mol/L氢氧化钠溶液(过量)注入上述锥形瓶中并加热、搅拌充分反应.写出反应化学方程式:


(5)冷却后,在锥形瓶中加入2-3滴酚酞,用0.10mol/L盐酸滴定未反应的氢氧化钠,左手控制活塞,右手轻摇锥形瓶,眼睛
| 滴定次数 | 0.1mol/L盐酸读数/mL | |
| 滴定前 | 滴定后 | |
| 1 | 0.00 | 17.98 |
| 2 | 1.56 | 16.58 |
| 3 | 0.22 | 15.20 |
(7)下列操作可能使测定结果(质量分数)偏高的是
A.配制盐酸溶液时俯视刻度线定容
B.锥形瓶瓶壁残留蒸馏水
C.滴定前酸式滴定管尖嘴处有气泡,滴定后气泡消失
D.量取氢氧化钠溶液体积时开始时仰视刻度线,结束时俯视刻度线.
阿司匹林被誉为“百年新药”,阿司匹林药片的有效成分是乙酰立杨酸,它是一种白色晶体,微溶于水.其结构简式为: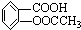 (相对分子质量为180).
(相对分子质量为180).
已知:阿司匹林药片中一般添加少量的辅料(都不溶于水,也不与NaOH反应);某课外学习小组为检验阿司匹林有效成分中的官能团并测定乙酰水杨酸在药片中的含量,进行了如下实验:
(1)用氢氧化钠固体配制250mL 0.10mol/L氢氧化钠溶液,完成有关填空.
a.计算所需氢氧化钠的质量;
b.向烧杯中加入适量水,搅拌、使其溶解;
c.用水洗涤烧杯、玻璃棒,洗液注入容量瓶;
d.在托盘天平上通过烧杯称量______g氢氧化钠固体;
e.盖好瓶塞,上下颠倒、摇匀;
f.冷却,将溶液移入250mL容量瓶中;
g.加水至距刻度线1-2cm处改用胶头滴管定容;
h.装瓶、贴上标签、备用
用字母表示正确的配制步骤(只填字母):______;
(2)配制250mL 0.10mol/L盐酸溶液;
(3)取阿司匹林药片于______中研碎,再称量0.3克放入锥形瓶中;滴定次数0.1mol/L盐酸读数/mL滴定前滴定后10.0017.9821.5616.5830.2215.20
(4)用碱式滴定管取25.00mL 0.10mol/L氢氧化钠溶液(过量)注入上述锥形瓶中并加热、搅拌充分反应.写出反应化学方程式:______;
(5)冷却后,在锥形瓶中加入2-3滴酚酞,用0.10mol/L盐酸滴定未反应的氢氧化钠,左手控制活塞,右手轻摇锥形瓶,眼睛______,直到溶液变为无色,在半分钟内不复原为止,记录读数.某学生取等质量阿司匹林完成实验,滴定前后的有关读数记录如图表:用有关数据计算该药片中乙酰水杨酸的质量分数为______;
| 滴定次数 | 0.1mol/L盐酸读数/mL | |
| 滴定前 | 滴定后 | |
| 1 | 0.00 | 17.98 |
| 2 | 1.56 | 16.58 |
| 3 | 0.22 | 15.20 |
(7)下列操作可能使测定结果(质量分数)偏高的是______.
A.配制盐酸溶液时俯视刻度线定容
B.锥形瓶瓶壁残留蒸馏水
C.滴定前酸式滴定管尖嘴处有气泡,滴定后气泡消失
D.量取氢氧化钠溶液体积时开始时仰视刻度线,结束时俯视刻度线. 查看习题详情和答案>>