摘要:已知A.B.C.D 4种元素.都是位于元素周期表中第一.二周期的元素.原子序数按A.C.D.B的顺序递增.A与C最外层电子数相同且都是1.B与C具有相同的电子层数.它们的最外层电子数相差6个.D元素最外层电子数是次外层电子数的3倍.试回答: (1)A.B.C.D的元素名称.原子的电子式.元素在周期表中的位置. (2)A与B.C与D.A与D都以何种化学键结合?形成什么型的化合物?分别写出它们的电子式. 班别 姓名 学号 成绩 选择题
网址:http://m.1010jiajiao.com/timu3_id_148668[举报]
已知A、B、C、D四种元素,A和B的离子结构都和氖原子具有相同的电子排布。C的离子结构比氖原子多8个电子,D的离子结构比氙原子少18个电子,A元素位于某一周期的开始,其离子的焰色为黄色;B元素的单质每摩尔能从酸中置换出1.5mol氢气,C元素离子的焰色为紫色;D元素的单质在常温下为液态,它的负一价离子能跟银离子反应生成不溶于硝酸的沉淀,
(1)四种元素的符号分别为:A________,B________,C________,D________。
(2)B、C两元素最高价氧化物水化物的化学式分别是________,________。
(3)在盛有B的氢氧化物的试管中,分别加入强酸和强碱时,其现象分别是________,________,离子方程式分别是________,________。
(4)A和D形成化合物的电子式是________,化合物中化学键类型为________。
查看习题详情和答案>>
已知A、B、C、D四种元素,A和B的离子结构都和氖原子具有相同的电子排布。C的离子结构比氖原子多8个电子,D的离子结构比氙原子少18个电子,A元素位于某一周期的开始,其离子的焰色为黄色;B元素的单质每摩尔能从酸中置换出1.5mol氢气,C元素离子的焰色为紫色;D元素的单质在常温下为液态,它的负一价离子能跟银离子反应生成不溶于硝酸的沉淀,
(1)四种元素的符号分别为:A________,B________,C________,D________。
(2)B、C两元素最高价氧化物水化物的化学式分别是________,________。
(3)在盛有B的氢氧化物的试管中,分别加入强酸和强碱时,其现象分别是________,________,离子方程式分别是________,________。
(4)A和D形成化合物的电子式是________,化合物中化学键类型为________。
查看习题详情和答案>>
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素.化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构.AC2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,三个氯离子位于外界.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为
(2)B的氢化物的分子空间构型是
(3)写出化合物AC2的电子式
 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为
;一种由B、C组成的化合物与AC2互为等电子体,其化学式为
(4)E的核外电子排布式是
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是
查看习题详情和答案>>
(1)A、B、C的第一电离能由小到大的顺序为
C<O<N
C<O<N
.(2)B的氢化物的分子空间构型是
三角锥型
三角锥型
.其中心原子采取sp3
sp3
杂化.(3)写出化合物AC2的电子式


N2O
N2O
.(4)E的核外电子排布式是
1s22s22p63s23p63d54s1
1s22s22p63s23p63d54s1
,ECl3形成的配合物的化学式为[Cr(NH3)4(H2O)2]Cl3
[Cr(NH3)4(H2O)2]Cl3
.(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是
4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O
4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O
.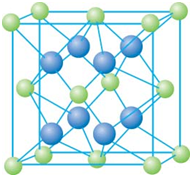 已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B形成的晶体其晶胞结构如图,图中小球代表D,大球代表B.请回答:
已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B形成的晶体其晶胞结构如图,图中小球代表D,大球代表B.请回答:(1)A元素的名称是
氢
氢
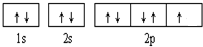
;(2)B元素的轨道表示式是


氟化氢分子间存在氢键,氯化氢分子间没有氢键
氟化氢分子间存在氢键,氯化氢分子间没有氢键
;(3)E属于元素周期表中第
四
四
周期,第VIIB
VIIB
族的元素,其元素名称是锰
锰
;属于元素周期表中的d
d
区(填元素分区),它的+2价离子的电子排布式为1s22s22p63s23p63d5
1s22s22p63s23p63d5
;(4)从图中可以看出,D跟B形成的离子化合物的化学式为
CaF2
CaF2
;该离子化合物晶体的密度为a g?cm-3,则晶胞的体积是| 4×78g/mol |
| ag/cm3×6.02×1023/mol |
| 4×78g/mol |
| ag/cm3×6.02×1023/mol |
已知A、B、C、D、E、F、G都是短周期的元素,它们的原子序数依次递增.A原子的电子层数与它的核外电子总数相同,而B原子的最外层电子数是次外层的2倍,C的氢化物可使湿润的红色石蕊试纸变蓝,B和D可以形成两种气态化合物,E原子核外电子总数比B的2倍少1,D与F同主族,G的原子半径是本周期元素中最小的.则:
(1)运送飞船的火箭燃料有一种液态化合物是由A、C元素组成的,已知该化合物的相对分子质量为32,其中氢元素的质量分数为12.5%.若该化合物与A2D2恰好完全反应,能产生两种无毒又不污染环境的物质,试写出该反应的化学方程式
(2)C的原子间也可形成链状结构,假设C原子间只以单键形式连接,并与A形成系列化合物,则该系列化合物的通式为
(3)由B和D以质量比为3:8组成的化合物与E的同周期相邻主族元素的单质反应的化学方程式为
(4)G单质与E的最高价氧化物的水化物反应的离子方程式为
查看习题详情和答案>>
(1)运送飞船的火箭燃料有一种液态化合物是由A、C元素组成的,已知该化合物的相对分子质量为32,其中氢元素的质量分数为12.5%.若该化合物与A2D2恰好完全反应,能产生两种无毒又不污染环境的物质,试写出该反应的化学方程式
N2H4+2H2O2═N2↑+4H2O
N2H4+2H2O2═N2↑+4H2O
(2)C的原子间也可形成链状结构,假设C原子间只以单键形式连接,并与A形成系列化合物,则该系列化合物的通式为
NnHn+2.
NnHn+2.
.(3)由B和D以质量比为3:8组成的化合物与E的同周期相邻主族元素的单质反应的化学方程式为
2Mg+CO2
2MgO+C
| ||
2Mg+CO2
2MgO+C
.
| ||
(4)G单质与E的最高价氧化物的水化物反应的离子方程式为
Cl2+2OH-═H2O+Cl-+ClO-.
Cl2+2OH-═H2O+Cl-+ClO-.
.