摘要:22.在100℃.0.5×105Pa下.有H2O和NH3两种气体. (1)若体积相同.则二者的分子个数比为 1∶1 .密度比为 18∶17 . (2)当二者氢原子数相等时.它们的体积之比是 3∶2 .
网址:http://m.1010jiajiao.com/timu3_id_148170[举报]
在给定条件下,下列加点的物质在对应的化学反应中能完全耗尽的是
A.向100.0 mL 5.00 mol/L的稀硝酸中加入5.6 g铁
B.用40.0 mI,10.00 mol/L的盐酸与10.0 g二氧化锰共热制取氯气
C.标准状况下,将1.0 g铝片投入20.0 mL,18.40 mol/L的硫酸中
D.在一定条件下,用5 mol氧气和1 mol二氧化硫合成三氧化硫
查看习题详情和答案>>
在给定条件下,下列加点的物质在对应的化学反应中能完全耗尽的是
- A.向100.0 mL 5.00 mol/L的稀硝酸中加入5.6 g铁
- B.用40.0 mI,10.00 mol/L的盐酸与10.0 g二氧化锰共热制取氯气
- C.标准状况下,将1.0 g铝片投入20.0 mL,18.40 mol/L的硫酸中
- D.在一定条件下,用5 mol氧气和1 mol二氧化硫合成三氧化硫
25 ℃时,在100 g 质量分数为10%的X溶液中加入5 g X(无水盐)后,恰好达到饱和,则25 ℃ 时X的溶解度为( )
重水(D2O)的离子积为1.6×10-15,可以用pH一样的定义来规定pD=-lgc(D+),以下关于pD的叙述正确的是( )
| A、中性溶液的pD=7.0 | B、含0.01 mol的NaOD的D2O溶液1 L,其pD=12.0 | C、溶解0.01 mol DCl的D2O溶液1 L,其pD=2.0 | D、在100 mL 0.25 mol?L-1的DCl重水溶液中,加入50 mL 0.2 mol?L-1的NaOD的重水溶液,其pD=1.0 |
(2013?杭州一模)某种甲酸酯水解反应方程式为:
HCOOR(l)+H2O(l)?HCOOH(l)+ROH (l)△H>0
某小组通过实验研究该反应(反应过程中体积变化忽略不计).反应体系中各组分的起始浓度如下表:
甲酸酯转化率在温度T1下随反应时间(t)的变化如图:
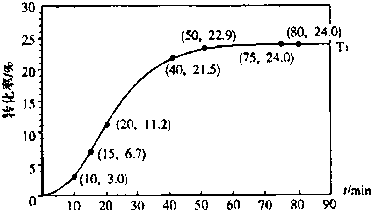
根据上述条件,计算不同时间范围内甲酸醋的平均反应速率,结果见下表:
(1)该反应的平衡常数K 的表达式
(不要求计算);T1温度下平衡体系中.c(ROH )为
(2)15~20min范围内用甲酸酯表示的平均反应速率为
(3)根据题给数据分析,从影响反应速率的角度来看,生成物甲酸在该反应中还起到了
查看习题详情和答案>>
HCOOR(l)+H2O(l)?HCOOH(l)+ROH (l)△H>0
某小组通过实验研究该反应(反应过程中体积变化忽略不计).反应体系中各组分的起始浓度如下表:
| 组分 | HCOOR | H2O | HCOOH } | ROH |
| 物质的量浓度/mol?L-1’ | 1.00 | 1.99 | 0.01 | 0.52 |

根据上述条件,计算不同时间范围内甲酸醋的平均反应速率,结果见下表:
| 反应时间/min | 0~5 | 10~15 | 20~25 | 30~35 | 40~45 | 50~55 | 75~80 |
| 平均速率/10-3mol?L-1?min-1 | 1.9 | 7.4 | 7.8 | 4.4 | 1.6 | 0.8 | 0.0 |
| c(ROH)c(HCOOH) |
| c(HCOOR)c(H2O) |
| c(ROH)c(HCOOH) |
| c(HCOOR)c(H2O) |
0.76
0.76
mol?L一1(2)15~20min范围内用甲酸酯表示的平均反应速率为
0.009
0.009
mol?L-1?min-1,(不要求写出计算过程).(3)根据题给数据分析,从影响反应速率的角度来看,生成物甲酸在该反应中还起到了
催化剂
催化剂
的作用.