摘要:现有含碘化钠30g 的溶液100g ,将它平分为两份.1.往一份中加入100g 17 % 的硝酸银溶液.可得到沉淀多少?
网址:http://m.1010jiajiao.com/timu3_id_147732[举报]
现有含CaO杂质的CaC2试样.某研究性学习小组的同学拟用以下三种方案测定CaC2试样的纯度(固体电石--CaC2与水可快速反应生成难溶于水的C2H2,反应方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑).请填写下列空白:
Ⅰ、第一种方案:请从图中选用适当的装置,设计一个实验,测定CaC2试样的纯度.

(1)制取C2H2最好选④中的
(2)若实验时称取的试样为1.4g,产生的乙炔在标准状况下的体积为448mL,此试样中CaC2的质量分数为
Ⅱ、第二种方案:根据试样和水在锥形瓶中反应前后质量的变化,测定CaC2的质量分数.先称取试样1.6g、锥形瓶和水的质量为195.0g,再将试样加入锥形瓶中,反应过程中每隔相同时间测得的数据如下表:
(3)计算CaC2的质量分数时,必需用的数据是
Ⅲ、第三种方案:称取一定质量的试样(1.6g),操作流程如下:

(4)操作Ⅱ的名称是
(5)要测定CaC2试样的纯度,还需知道的数据是
(6)在转移溶液时,如溶液转移不完全,则CaC2质量分数的测定结果
查看习题详情和答案>>
Ⅰ、第一种方案:请从图中选用适当的装置,设计一个实验,测定CaC2试样的纯度.

(1)制取C2H2最好选④中的
丙
丙
.所选用装置的连接顺序是(填各接口A~E的顺序):E、C、D、B
E、C、D、B
.(2)若实验时称取的试样为1.4g,产生的乙炔在标准状况下的体积为448mL,此试样中CaC2的质量分数为
91.4%
91.4%
.Ⅱ、第二种方案:根据试样和水在锥形瓶中反应前后质量的变化,测定CaC2的质量分数.先称取试样1.6g、锥形瓶和水的质量为195.0g,再将试样加入锥形瓶中,反应过程中每隔相同时间测得的数据如下表:
| 读数次数 | 质量/g | |
锥形瓶十水十试样 |
第1次 | 196.4 |
| 第2次 | 196.2 | |
| 第3次 | 196.1 | |
| 第4次 | 196.0 | |
| 第5次 | 196.0 |
试样质量、锥形瓶和水的质量、第4、5次读数
试样质量、锥形瓶和水的质量、第4、5次读数
.不必作第6次读数的原因是第4、5次实验读数相同,表明锥形瓶内质量已达恒重,反应进行完全
第4、5次实验读数相同,表明锥形瓶内质量已达恒重,反应进行完全
.Ⅲ、第三种方案:称取一定质量的试样(1.6g),操作流程如下:

(4)操作Ⅱ的名称是
蒸发
蒸发
.(5)要测定CaC2试样的纯度,还需知道的数据是
CaCl2质量
CaCl2质量
.(6)在转移溶液时,如溶液转移不完全,则CaC2质量分数的测定结果
偏大
偏大
(填“偏大”、“偏小”或“不变”).已知Cl-和Ag+反应生成AgCl,每次新生成的AgCl中又有10%见光分解成单质银和氯气,氯气又可在水溶液中岐化成HClO3(为强酸)和HCl。而这样生成的Cl-又与剩余的Ag+作用生成沉淀,如此循环往复,直至最终。现有含1.1molNaCl的溶液,向其中加入足量AgNO3,求最终能生成多少克难溶物(AgCl和Ag)?若最后溶液体积为1L,求溶液中H+物质的量浓度是多少?
查看习题详情和答案>>
现有含CaO杂质的CaC2试样.某研究性学习小组的同学拟用以下三种方案测定CaC2试样的纯度(固体电石--CaC2与水可快速反应生成难溶于水的C2H2,反应方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑).请填写下列空白:
Ⅰ、第一种方案:请从图中选用适当的装置,设计一个实验,测定CaC2试样的纯度.
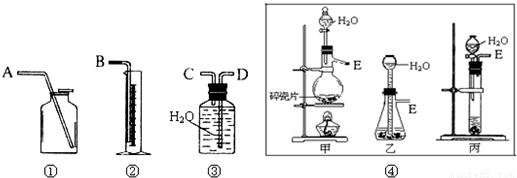
(1)制取C2H2最好选④中的______.所选用装置的连接顺序是(填各接口A~E的顺序):______.
(2)若实验时称取的试样为1.4g,产生的乙炔在标准状况下的体积为448mL,此试样中CaC2的质量分数为______.
Ⅱ、第二种方案:根据试样和水在锥形瓶中反应前后质量的变化,测定CaC2的质量分数.先称取试样1.6g、锥形瓶和水的质量为195.0g,再将试样加入锥形瓶中,反应过程中每隔相同时间测得的数据如下表:
(3)计算CaC2的质量分数时,必需用的数据是______.不必作第6次读数的原因是______.
Ⅲ、第三种方案:称取一定质量的试样(1.6g),操作流程如下:
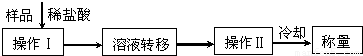
(4)操作Ⅱ的名称是______.
(5)要测定CaC2试样的纯度,还需知道的数据是______.
(6)在转移溶液时,如溶液转移不完全,则CaC2质量分数的测定结果______(填“偏大”、“偏小”或“不变”).
查看习题详情和答案>>
Ⅰ、第一种方案:请从图中选用适当的装置,设计一个实验,测定CaC2试样的纯度.

(1)制取C2H2最好选④中的______.所选用装置的连接顺序是(填各接口A~E的顺序):______.
(2)若实验时称取的试样为1.4g,产生的乙炔在标准状况下的体积为448mL,此试样中CaC2的质量分数为______.
Ⅱ、第二种方案:根据试样和水在锥形瓶中反应前后质量的变化,测定CaC2的质量分数.先称取试样1.6g、锥形瓶和水的质量为195.0g,再将试样加入锥形瓶中,反应过程中每隔相同时间测得的数据如下表:
| 读数次数 | 质量/g | |
锥形瓶十水十试样 | 第1次 | 196.4 |
| 第2次 | 196.2 | |
| 第3次 | 196.1 | |
| 第4次 | 196.0 | |
| 第5次 | 196.0 |
Ⅲ、第三种方案:称取一定质量的试样(1.6g),操作流程如下:

(4)操作Ⅱ的名称是______.
(5)要测定CaC2试样的纯度,还需知道的数据是______.
(6)在转移溶液时,如溶液转移不完全,则CaC2质量分数的测定结果______(填“偏大”、“偏小”或“不变”).
查看习题详情和答案>>
 已知溶液中:还原性HSO3->I-,氧化性:IO3->I2>SO42-.在含3mol NaHSO3的溶逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系如图所示,则下列说法错误的是( )
已知溶液中:还原性HSO3->I-,氧化性:IO3->I2>SO42-.在含3mol NaHSO3的溶逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系如图所示,则下列说法错误的是( )