网址:http://m.1010jiajiao.com/timu3_id_147599[举报]
(1)NO对环境的危害在于________(填编号)。
A.破坏臭氧层 B.高温下能使一些金属氧化 C.造成酸雨 D.与人体血红蛋白结合
(2)在含Cu+的酶的活化中心,亚硝酸根离子(NO2-)可转化为NO,写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式: ____________________________。
(3)“绿色奥运”是2008年北京奥运会的主题之一,为迎接奥运,减少空气污染,北京为汽车加装了“三效催化净化器”,可将尾气中的一氧化碳和一氧化氮转化为参与大气循环的无毒混合气体,该气体是__________
A.二氧化碳和氮气 B.二氧化碳和二氧化氮 C.二氧化碳和氧气 D.二氧化碳和氢气
(4)氟利昂(如CCl2F2)可在光的作用下分解,产生氯原子,氯原子会对臭氧层产生长久的破坏作用(臭氧的分子式为O3)。有关反应如下:
O3
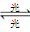 O2+O Cl+O3→ClO+O2 ClO+O→Cl+O2
O2+O Cl+O3→ClO+O2 ClO+O→Cl+O2总反应:2O3→3O2,在上述臭氧变成氧气的反应过程中,Cl是____________。
运用化学反应原理研究碳、氮、硫、氯等单质及其化合物的反应,对生产、生活、环境保护等领域有着重要的意义。
(1)下列措施中,不利于环境保护的有 (填编号)。
a.大量开采使用化石燃料
b.使用无氟冰箱、空调
c.多步行多乘公交车,少用专车和私家车
d.将工业“废气”、“废液”、“废渣”直接排放
(2)工业上的“脱碳”指的是从“脱硝”、“脱硫”后的烟气用碱液吸收并得到浓缩的二氧化碳。利用二氧化碳合成甲醇是碳减排的新方向。
①写出吸收二氧化碳的离子方程式 。
②常温下,0.1mol/LNaHCO3溶液的pH>8,则溶液中c(H2CO3) _______c(CO32-) (填“>”、“<”或“=”)。
③合成的甲醇可以做为新型燃料电池的原料,若电解液是碱性的,则其负极的电极反应式为 。
(3)二氧化氯(ClO2),为一种黄绿色气体,是公认的高效、广谱安全的杀菌消毒剂。工业上制备ClO2的反应原理为:4HC1(浓)+2NaClO3=2ClO2↑+Cl2↑+2H2O+2NaCl。上述反应中,产生1 mol ClO2,则被氧化的HC1为 。
(4)SO2溶于水可以得到二元弱酸H2SO3(亚硫酸)。
①25℃时,将NaOH深液与亚硫酸混合至恰好中和,则混合液中各种离子浓度的大小关系为 。
②25℃时,当NaOH溶液与H2SO3等物质的量混合时,发现混合液pH<7,请你简要解释其原因 。
查看习题详情和答案>>
运用化学反应原理研究碳、氮、硫、氯等单质及其化合物的反应,对生产、生活、环境保护等领域有着重要的意义。
(1)下列措施中,不利于环境保护的有 (填编号)。
a.大量开采使用化石燃料
b.使用无氟冰箱、空调
c.多步行多乘公交车,少用专车和私家车
d.将工业“废气”、“废液”、“废渣”直接排放
(2)工业上的“脱碳”指的是从“脱硝”、“脱硫”后的烟气用碱液吸收并得到浓缩的二氧化碳。利用二氧化碳合成甲醇是碳减排的新方向。
①写出吸收二氧化碳的离子方程式 。
②常温下,0.1mol/LNaHCO3溶液的pH>8,则溶液中c(H2CO3) _______c(CO32-) (填“>”、“<”或“=”)。
③合成的甲醇可以做为新型燃料电池的原料,若电解液是碱性的,则其负极的电极反应式为 。
(3)二氧化氯(ClO2),为一种黄绿色气体,是公认的高效、广谱安全的杀菌消毒剂。工业上制备ClO2的反应原理为:4HC1(浓)+2NaClO3=2ClO2↑+Cl2↑+2H2O+2NaCl。上述反应中,产生1 mol ClO2,则被氧化的HC1为 。
(4)SO2溶于水可以得到二元弱酸H2SO3(亚硫酸)。
①25℃时,将NaOH深液与亚硫酸混合至恰好中和,则混合液中各种离子浓度的大小关系为 。
②25℃时,当NaOH溶液与H2SO3等物质的量混合时,发现混合液pH<7,请你简要解释其原因 。
(1)下列措施中,不利于环境保护的有 (填编号)。
a.大量开采使用化石燃料
b.使用无氟冰箱、空调
c.多步行多乘公交车,少用专车和私家车
d.将工业“废气”、“废液”、“废渣”直接排放
(2)工业上的“脱碳”指的是从“脱硝”、“脱硫”后的烟气用碱液吸收并得到浓缩的二氧化碳。利用二氧化碳合成甲醇是碳减排的新方向。
①写出吸收二氧化碳的离子方程式 。
②常温下,0.1mol/LNaHCO3溶液的pH>8,则溶液中c(H2CO3) _______c(CO32-) (填“>”、“<”或“=”)。
③合成的甲醇可以做为新型燃料电池的原料,若电解液是碱性的,则其负极的电极反应式为 。
(3)二氧化氯(ClO2),为一种黄绿色气体,是公认的高效、广谱安全的杀菌消毒剂。工业上制备ClO2的反应原理为:4HC1(浓)+2NaClO3=2ClO2↑+Cl2↑+2H2O+2NaCl。上述反应中,产生1 mol ClO2,则被氧化的HC1为 。
(4)SO2溶于水可以得到二元弱酸H2SO3(亚硫酸)。
①25℃时,将NaOH深液与亚硫酸混合至恰好中和,则混合液中各种离子浓度的大小关系为 。
②25℃时,当NaOH溶液与H2SO3等物质的量混合时,发现混合液pH<7,请你简要解释其原因 。
①为确保世博会期间空气质量的优良率,有关部门要定时测定空气中的可吸入颗粒物、二氧化硫和
a.氟氯烃 b.二氧化氮 c.二氧化碳
②世博会停车场安装有汽车尾气催化光解设施,它能使汽车尾气中的CO和NO2在一定条件下反应生成可参与大气生态循环的无毒害气体,该反应的化学方程式为
③在中和法、过滤法、沉淀法这3种污水处理的方法中,一定不发生化学反应的是
(2)营养物质和药物是人体健康的保证.
①水果中含有维生素C,向一片新鲜水果的切面上滴加淀粉溶液和碘水,出现蓝色后又慢慢褪去,说明维生素C具有
②某品牌抗酸药的主要成分有糖衣、氢氧化铝、淀粉,该抗酸药的有效成分为
(3)材料是人类生存和发展的基础,合理使用材料可改善人类的生活.
①下列硅酸盐材料的生产原料中,不需要石灰石的是
a.玻璃 b.陶瓷 c.水泥
②铝合金是用途广泛的金属材料,铝制物品能经久耐用的原因是
③三大合成材料是指塑料、合成纤维和