摘要:22.实验室需要480mL 0.2mol/L的稀硫酸溶液,现用密度为1.84g/mL.质量分数为 98%浓硫酸配制,填空并请回答下列问题: (1) 配制该硫酸溶液应选用容量瓶的规格 除容量瓶外还需要的仪器是 量取浓硫酸的体积是 mL, (2)配制时.其正确的操作顺序是(字母表示.每个字母只能用一次) , A.用50mL水洗涤烧杯2-3次.洗涤液均注入容量瓶.振荡 B.先在烧杯中加入适量水.用量筒准确量取所需的浓硫酸的体积. 沿烧杯壁倒入烧杯中..用玻璃棒慢慢搅动.使其混合均匀 C.将已冷却的硫酸沿玻璃棒注入500mL的容量瓶中 D.将容量瓶盖紧.振荡.摇匀 E.改用胶头滴管加水.使溶液凹面恰好与刻度相切 F.继续往容量瓶内小心加水.直到液面接近刻度1-2cm处 (3)若出现如下情况.对所配溶液浓度将有何影响(填“偏高 .“偏低 或“无影响 )? 若没有进行A操作 ,若加蒸馏水时不慎超过了刻度 ,若定容时俯视刻度线 . (4)若加蒸馏水时不慎超过了刻度线.应如何处理? ,
网址:http://m.1010jiajiao.com/timu3_id_147588[举报]
 实验室需要480mL 0.4mol?L-1的NaCl溶液,有如下操作步骤:
实验室需要480mL 0.4mol?L-1的NaCl溶液,有如下操作步骤:①用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀.
②把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶解.
③将容量瓶瓶塞塞紧,充分摇匀.
④把②所得溶液小心转入一定容积的容量瓶中.
⑤继续向容量瓶中加蒸馏水至液面距刻度线1cm~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切.
请填写下列空白:
(1)操作步骤的正确顺序为(填序号)
②④①⑤③
②④①⑤③
.(2)实验室有如下规格的容量瓶:①100mL,②250mL,③500mL,④1 000mL,本实验选用
③
③
(填序号).(3)本实验用到的基本实验仪器除容量瓶、玻璃棒外还有:
天平、烧杯、胶头滴管
天平、烧杯、胶头滴管
.(4)需要使用玻璃棒的操作有
①②④
①②④
(填序号),其作用为搅拌、引流
搅拌、引流
.(5)误差分析:(填“偏高”、“偏低”或“无影响”)
①称量NaCl时,物码倒置(1g以下用游码):
偏低
偏低
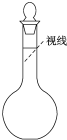
.②某同学观察液面的情况如图所示:
偏高
偏高
.③没有进行操作步骤①:
偏低
偏低
.④加蒸馏水时不慎超过了刻度线,立即用胶头滴管将多余的水吸出:
偏低
偏低
.⑤容量瓶原来有少量水:
无影响
无影响
.实验室需要480mL 0.1mol/L的Na2CO3溶液,现进行配制.回答下列问题:
(1)应用托盘天平称取碳酸钠晶体(Na2CO3?10H2O)的质量为
(2)若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上,天平平衡时,则实际称量的碳酸钠晶体的质量为
(3)配制Na2CO3溶液时需用的主要仪器有托盘天平、玻璃棒、烧杯、
(4)若实验遇下列情况,溶液的浓度会受何影响.(填“偏高”、“偏低”或“不变”)
A.配制前容量瓶内仍有蒸馏水而未干燥处理
B.忘记将洗涤液转移至容量瓶
C.加水时越过刻度线
D.称取的碳酸钠晶体因风化已失去部分结晶水
查看习题详情和答案>>
(1)应用托盘天平称取碳酸钠晶体(Na2CO3?10H2O)的质量为
14.3g
14.3g
.(2)若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上,天平平衡时,则实际称量的碳酸钠晶体的质量为
13.7g
13.7g
.(1g以下用游码)(3)配制Na2CO3溶液时需用的主要仪器有托盘天平、玻璃棒、烧杯、
500mL容量瓶
500mL容量瓶
、胶头滴管
胶头滴管
.(4)若实验遇下列情况,溶液的浓度会受何影响.(填“偏高”、“偏低”或“不变”)
A.配制前容量瓶内仍有蒸馏水而未干燥处理
不变
不变
B.忘记将洗涤液转移至容量瓶
偏低
偏低
C.加水时越过刻度线
偏低
偏低
D.称取的碳酸钠晶体因风化已失去部分结晶水
偏高
偏高
. 实验室需要480mL 0.4mol?L-1的NaCl溶液,有如下操作步骤:
实验室需要480mL 0.4mol?L-1的NaCl溶液,有如下操作步骤:①把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶解.
②把①所得溶液小心转入一定容积的容量瓶中.
③继续向容量瓶中加蒸馏水至液面距刻度线1cm~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切.
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀.
⑤将容量瓶瓶塞塞紧,充分摇匀.
请填写下列空白:
(1)操作步骤的正确顺序为(填序号)
①②④③⑤
①②④③⑤
.(2)实验室有如下规格的容量瓶:①100mL,②250mL,③500mL,④1 000mL,本实验选用
③
③
(填序号).(3)本实验用到的基本实验仪器除容量瓶、玻璃棒外还有:
天平、药匙、烧杯、胶头滴管
天平、药匙、烧杯、胶头滴管
.(4)需要使用玻璃棒的操作有
①②③④
①②③④
(填序号),其作用为搅拌、引流
搅拌、引流
.(5)误差分析:(填“偏高”、“偏低”或“无影响”)
①称量NaCl时,物码倒置(1g以下用游码):
偏低
偏低
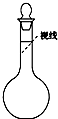
.②某同学观察液面的情况如图所示:
偏高
偏高
.③没有进行操作步骤④:
偏低
偏低
.④加蒸馏水时不慎超过了刻度线,立即用胶头滴管将多余的水吸出:
偏低
偏低
.⑤容量瓶原来有少量水:
无影响
无影响
.实验室需要480mL 0.4mol/L的NaCl溶液,有如下操作步骤:
①把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶解.
②把①所得溶液小心转入一定容积的容量瓶中.
③继续向容量瓶中加蒸馏水至液面距刻度线1cm~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切.
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀.
⑤将容量瓶瓶塞塞紧,充分摇匀.
请填写下列空白:
(1)操作步骤的正确顺序为(填序号)
(2)实验室有如下规格的容量瓶:①100mL,②250mL,③500mL,④1000mL,本实验选用
(3)本实验用到的基本实验仪器除容量瓶、玻璃棒外还有
(4)需要使用玻璃棒的操作有
(5)误差分析:(填“偏高”、“偏低”或“无影响”)
①称量NaCl时,物码倒置(1g以下用游码)
②容量瓶使用前,用1mol/L的NaCl溶液润洗
查看习题详情和答案>>
①把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶解.
②把①所得溶液小心转入一定容积的容量瓶中.
③继续向容量瓶中加蒸馏水至液面距刻度线1cm~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切.
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀.
⑤将容量瓶瓶塞塞紧,充分摇匀.
请填写下列空白:
(1)操作步骤的正确顺序为(填序号)
①②④③⑤
①②④③⑤
.(2)实验室有如下规格的容量瓶:①100mL,②250mL,③500mL,④1000mL,本实验选用
③
③
(填序号).(3)本实验用到的基本实验仪器除容量瓶、玻璃棒外还有
托盘天平、药匙、烧杯、胶头滴管、量筒
托盘天平、药匙、烧杯、胶头滴管、量筒
.(4)需要使用玻璃棒的操作有
①②③④
①②③④
(填序号),其作用为搅拌,促进溶解;引流
搅拌,促进溶解;引流
.(5)误差分析:(填“偏高”、“偏低”或“无影响”)
①称量NaCl时,物码倒置(1g以下用游码)
偏低
偏低
;②容量瓶使用前,用1mol/L的NaCl溶液润洗
偏高
偏高
.实验室需要480mL 0.5mol?L?1的NaOH溶液,配制过程中有如下操作步骤:
①把称量好的NaOH固体放入小烧杯中,加适量蒸馏水溶解;
②把①所得溶液小心转入
③继续向容量瓶中加蒸馏水至液面距离刻度l~2cm处,改用胶头滴管小心滴加适量的蒸馏水后停止滴加;
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;
⑤将容量瓶塞紧,充分摇匀.
⑥待溶液恢复到室温.
请填写下列空白:
(1)实验操作步骤的正确顺序为(填序号)
(2)实验中用托盘天平称取NaOH固体的质量是
(3)若实验时出现如下情况,使所配溶液的物质的量浓度偏高的有
A.在托盘天平上称取氢氧化钠固体时,将砝码放在天平的左盘,盛有氢氧化钠固体的小烧杯放在天平的右盘.
B.定容时,俯视刻度线.
C.移液后,未洗涤烧杯和玻璃棒.
D.容量瓶中原有少量的蒸馏水
E.前一次配制定容时加水超过了刻度线,所以将溶液倒掉了,后来容量瓶未用蒸馏水润洗,就重新配制溶液.
查看习题详情和答案>>
①把称量好的NaOH固体放入小烧杯中,加适量蒸馏水溶解;
②把①所得溶液小心转入
500mL容量瓶
500mL容量瓶
中;③继续向容量瓶中加蒸馏水至液面距离刻度l~2cm处,改用胶头滴管小心滴加适量的蒸馏水后停止滴加;
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;
⑤将容量瓶塞紧,充分摇匀.
⑥待溶液恢复到室温.
请填写下列空白:
(1)实验操作步骤的正确顺序为(填序号)
①⑥②④③⑤
①⑥②④③⑤
.步骤②中该填500mL容量瓶
500mL容量瓶
.(2)实验中用托盘天平称取NaOH固体的质量是
10.0g
10.0g
.(3)若实验时出现如下情况,使所配溶液的物质的量浓度偏高的有
BE
BE
.A.在托盘天平上称取氢氧化钠固体时,将砝码放在天平的左盘,盛有氢氧化钠固体的小烧杯放在天平的右盘.
B.定容时,俯视刻度线.
C.移液后,未洗涤烧杯和玻璃棒.
D.容量瓶中原有少量的蒸馏水
E.前一次配制定容时加水超过了刻度线,所以将溶液倒掉了,后来容量瓶未用蒸馏水润洗,就重新配制溶液.