摘要: 已知每1g葡萄糖完全氧化后能放出15.58kJ能量.某潜水员携带2mol O2,他在水下工作时每1分钟要消耗70kJ能量.问他在水下坚持工作的时间最长为 ( ) A.20分钟 B.14分钟 C.16分钟 D.20分钟
网址:http://m.1010jiajiao.com/timu3_id_146608[举报]
在我国,人们的主食营养成分中糖的比例最大。而人的生命活动所需能量约70%以上是由食物中的糖提供,其变化的主要过程可表示为:
![]()
请回答有关问题:
(1)人们的主食中所含糖类物质主要成分是__________;通常所说的“血糖”是指血液中所含的__________(填写具体名称)。
(2)从能量代谢的角度看,甲过程可认为是人体__________过程,乙过程是人体__________过程。
(3)已知每克葡萄糖完全氧化可释放能量为 15.6 kJ,试写出其热化学方程式:____________________________________________________
一般成年男子维持正常的生命活动每日约需6 270 kJ能量,若因某种疾病不能进食,只能靠输液维持,则在24小时内需输10%的葡萄糖溶液__________mL。(密度为
甲醇又称“木精”,是重要的溶剂和基本有机原料.工业上常以CO和H2为原料合成甲醇.
(1)已知每1g液态甲醇不完全燃烧生成一氧化碳和液态水时放出13.8kJ热量,写出甲醇不完全燃烧的热化学方程式: .
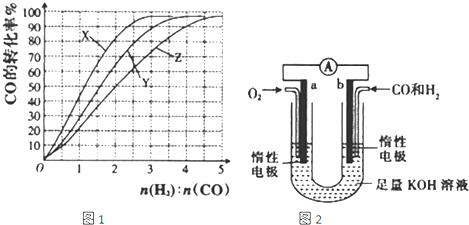
(2)工业上常利用反应:CO(g)+2H2(g)=CH3OH(g)△H<0合成甲醇,其在230~270℃下反应最为有利.为研究合成气最合适的起始组成比,在230℃、250℃和270℃进行实验,结果如图所示,则230℃时的实验结果所对应的曲线是 (填字母,下同);该温度下工业生产适宜采用的合成气组成n(H2):n(CO)的比值范围是 .
A.1~1.5B.2.5~3C.3.5~4.5
(3)制甲醇所需要的氢气,可用下列反应制取:HO2(g)+CO(g)?H2(g)+CO2(g)△H<0
150℃时,在容积为2L的恒温恒容密闭容器中充入1mol CO和2molH2O(g),反应达到平衡后测得H2的体积分数为25%.
①平衡时CO的转化率为 .
②150℃下,若起始时充入2molCO和4molH2O(g),反应达到平衡时CO2的体积分数为 .
(4)某研究小组设计了如图所示的原电池装置,向导管中通入物质的量之比为1:1的CO和H2混合气体(CO和H2同时放电).
①电池工作一段时间后,电解质溶液的pH (填“增大”、“减小”或“不变”).
②电池工作一段时间后,测得电解质溶液增重6.2g(不考虑未反应气体的溶解),则负极参加反应的气体质量为 .
查看习题详情和答案>>
(1)已知每1g液态甲醇不完全燃烧生成一氧化碳和液态水时放出13.8kJ热量,写出甲醇不完全燃烧的热化学方程式:
(2)工业上常利用反应:CO(g)+2H2(g)=CH3OH(g)△H<0合成甲醇,其在230~270℃下反应最为有利.为研究合成气最合适的起始组成比,在230℃、250℃和270℃进行实验,结果如图所示,则230℃时的实验结果所对应的曲线是
A.1~1.5B.2.5~3C.3.5~4.5

(3)制甲醇所需要的氢气,可用下列反应制取:HO2(g)+CO(g)?H2(g)+CO2(g)△H<0
150℃时,在容积为2L的恒温恒容密闭容器中充入1mol CO和2molH2O(g),反应达到平衡后测得H2的体积分数为25%.
①平衡时CO的转化率为
②150℃下,若起始时充入2molCO和4molH2O(g),反应达到平衡时CO2的体积分数为
(4)某研究小组设计了如图所示的原电池装置,向导管中通入物质的量之比为1:1的CO和H2混合气体(CO和H2同时放电).
①电池工作一段时间后,电解质溶液的pH
②电池工作一段时间后,测得电解质溶液增重6.2g(不考虑未反应气体的溶解),则负极参加反应的气体质量为
随着我国家用汽车数量的迅猛增加,加速了城市空气污染.往汽油中添加10%至15%的酒精,可以减少70%以上的污染.已知每46g酒精完全燃烧生成液态水时放出的热量为1367kJ.请写出酒精完全燃烧的热化学方程式:
查看习题详情和答案>>
C2H5OH(l)+3O2(g)→2CO2(g)+3H2O(l);△H=-1367kJ?mol-1
C2H5OH(l)+3O2(g)→2CO2(g)+3H2O(l);△H=-1367kJ?mol-1
.