摘要:将等物质的量的Cl2和SO2通入水中.充分反应以后.加入紫色石蕊试液和BaCl2溶液. 以下叙述中正确的是 ( ) A.产生BaSO4白色沉淀.溶液变为红色 B.产生BaSO4白色沉淀.溶液变为无色 C.无沉淀生成.溶液变为无色 D.无沉淀生成.溶液变为红色
网址:http://m.1010jiajiao.com/timu3_id_145972[举报]
将等物质的量的HBr和SO2通入水中形成溶液,再向溶液中通入1 mol Cl2,有一半Br-转变为Br2,原混合气体中SO2的物质的量为
- A.0.8mol
- B.1.6mol
- C.2mol
- D.4mol
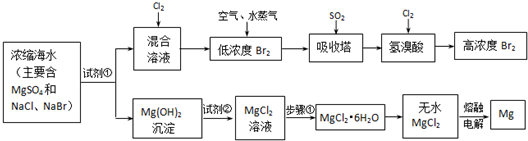
(附加题)海水中化学资源的综合开发利用,已受到各国的高度重视.Br2和Mg等两种单质都可以从海水中提取,下图为提取它们的主要步骤:
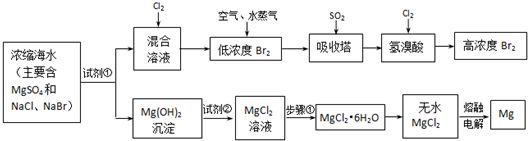
请回答:
Ⅰ.从海水中提取的溴占世界溴年产量的1/3,主要方法就是上述流程中的空气吹出法.
(1)制取Br2时第一次通入Cl2时发生反应的离子方程式是
(2)吸收塔中反应的离子方程式是
由(1)、(2)可知,SO2、Cl2、Br2 三种物质氧化性由强到弱的顺序是
Ⅱ.镁及其合金是用途很广的金属材料,而目前世界上60%的镁就是从海水中按上述流程提取的.
(1)上述流程中为了使MgSO4完全转化为Mg(OH)2,试剂①可以选用
(2)加入试剂②后反应的离子方程式是
(3)步骤①包括加热、蒸发、冷却、结晶、
(4)通电时无水MgCl2在熔融状态下反应的化学方程式是
Ⅲ.上述流程在生产溴和镁的同时还可以制得其他化工物质,比如制备耐火材料氧化镁和盐酸.生产方法是:
①将氯化镁晶体(MgCl2?6H2O)加热到523℃以上,该晶体可以分解得到耐火材料氧化镁和两种气态化合物,其中一种气体常温下为无色液体.
②将两种气体冷却至室温,再根据需要,加入不同量的水,就可得到不同浓度的盐酸.
(1)MgCl2?6H2O在523℃以上分解的化学方程式是
(2)现用1mol MgCl2?6H2O分解所得的非固体产物来制取密度为1.19g/cm3的盐酸溶液168mL,需加水
查看习题详情和答案>>

请回答:
Ⅰ.从海水中提取的溴占世界溴年产量的1/3,主要方法就是上述流程中的空气吹出法.
(1)制取Br2时第一次通入Cl2时发生反应的离子方程式是
Cl2+2Br-═2Cl-+Br2
Cl2+2Br-═2Cl-+Br2
.(2)吸收塔中反应的离子方程式是
Br2+SO2+2H2O═4H++SO42-+2Br-
Br2+SO2+2H2O═4H++SO42-+2Br-
.由(1)、(2)可知,SO2、Cl2、Br2 三种物质氧化性由强到弱的顺序是
Cl2>Br2>SO2
Cl2>Br2>SO2
.(用“>”表示)Ⅱ.镁及其合金是用途很广的金属材料,而目前世界上60%的镁就是从海水中按上述流程提取的.
(1)上述流程中为了使MgSO4完全转化为Mg(OH)2,试剂①可以选用
NaOH
NaOH
(写化学式).(2)加入试剂②后反应的离子方程式是
Mg(OH)2+2H+═Mg2++2H2O
Mg(OH)2+2H+═Mg2++2H2O
.(3)步骤①包括加热、蒸发、冷却、结晶、
过滤
过滤
.(4)通电时无水MgCl2在熔融状态下反应的化学方程式是
MgCl2(熔融)
Mg+Cl2↑
| ||
MgCl2(熔融)
Mg+Cl2↑
.
| ||
Ⅲ.上述流程在生产溴和镁的同时还可以制得其他化工物质,比如制备耐火材料氧化镁和盐酸.生产方法是:
①将氯化镁晶体(MgCl2?6H2O)加热到523℃以上,该晶体可以分解得到耐火材料氧化镁和两种气态化合物,其中一种气体常温下为无色液体.
②将两种气体冷却至室温,再根据需要,加入不同量的水,就可得到不同浓度的盐酸.
(1)MgCl2?6H2O在523℃以上分解的化学方程式是
MgCl2?6H2O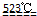 MgO+2 HCl↑+5H2O↑
MgO+2 HCl↑+5H2O↑
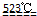 MgO+2 HCl↑+5H2O↑
MgO+2 HCl↑+5H2O↑MgCl2?6H2O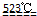 MgO+2 HCl↑+5H2O↑
MgO+2 HCl↑+5H2O↑
.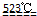 MgO+2 HCl↑+5H2O↑
MgO+2 HCl↑+5H2O↑(2)现用1mol MgCl2?6H2O分解所得的非固体产物来制取密度为1.19g/cm3的盐酸溶液168mL,需加水
36.9 g
36.9 g
g(精确到0.1),该盐酸中溶质的物质的量浓度是11.9
11.9
mol/L(精确到0.1).(附加题)海水中化学资源的综合开发利用,已受到各国的高度重视.Br2和Mg等两种单质都可以从海水中提取,下图为提取它们的主要步骤:
请回答:
Ⅰ.从海水中提取的溴占世界溴年产量的1/3,主要方法就是上述流程中的空气吹出法.
(1)制取Br2时第一次通入Cl2时发生反应的离子方程式是______.
(2)吸收塔中反应的离子方程式是______.
由(1)、(2)可知,SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是______.(用“>”表示)
Ⅱ.镁及其合金是用途很广的金属材料,而目前世界上60%的镁就是从海水中按上述流程提取的.
(1)上述流程中为了使MgSO4完全转化为Mg(OH)2,试剂①可以选用______(写化学式).
(2)加入试剂②后反应的离子方程式是______.
(3)步骤①包括加热、蒸发、冷却、结晶、______.
(4)通电时无水MgCl2在熔融状态下反应的化学方程式是______.
Ⅲ.上述流程在生产溴和镁的同时还可以制得其他化工物质,比如制备耐火材料氧化镁和盐酸.生产方法是:
①将氯化镁晶体(MgCl2?6H2O)加热到523℃以上,该晶体可以分解得到耐火材料氧化镁和两种气态化合物,其中一种气体常温下为无色液体.
②将两种气体冷却至室温,再根据需要,加入不同量的水,就可得到不同浓度的盐酸.
(1)MgCl2?6H2O在523℃以上分解的化学方程式是______.
(2)现用1molMgCl2?6H2O分解所得的非固体产物来制取密度为1.19g/cm3的盐酸溶液168mL,需加水______g(精确到0.1),该盐酸中溶质的物质的量浓度是______mol/L(精确到0.1).
查看习题详情和答案>>

请回答:
Ⅰ.从海水中提取的溴占世界溴年产量的1/3,主要方法就是上述流程中的空气吹出法.
(1)制取Br2时第一次通入Cl2时发生反应的离子方程式是______.
(2)吸收塔中反应的离子方程式是______.
由(1)、(2)可知,SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是______.(用“>”表示)
Ⅱ.镁及其合金是用途很广的金属材料,而目前世界上60%的镁就是从海水中按上述流程提取的.
(1)上述流程中为了使MgSO4完全转化为Mg(OH)2,试剂①可以选用______(写化学式).
(2)加入试剂②后反应的离子方程式是______.
(3)步骤①包括加热、蒸发、冷却、结晶、______.
(4)通电时无水MgCl2在熔融状态下反应的化学方程式是______.
Ⅲ.上述流程在生产溴和镁的同时还可以制得其他化工物质,比如制备耐火材料氧化镁和盐酸.生产方法是:
①将氯化镁晶体(MgCl2?6H2O)加热到523℃以上,该晶体可以分解得到耐火材料氧化镁和两种气态化合物,其中一种气体常温下为无色液体.
②将两种气体冷却至室温,再根据需要,加入不同量的水,就可得到不同浓度的盐酸.
(1)MgCl2?6H2O在523℃以上分解的化学方程式是______.
(2)现用1molMgCl2?6H2O分解所得的非固体产物来制取密度为1.19g/cm3的盐酸溶液168mL,需加水______g(精确到0.1),该盐酸中溶质的物质的量浓度是______mol/L(精确到0.1).