网址:http://m.1010jiajiao.com/timu3_id_145957[举报]
A.酸性 B.氧化性 C.还原性 D.吸水性 E.脱水性 F.难挥发性
( )①Hg+2H2SO4(浓) ![]() HgSO4+SO2↑+2H2O
HgSO4+SO2↑+2H2O
( )②Cu(OH)2+H2SO4 ![]() CuSO4+2H2O
CuSO4+2H2O
( )③Fe2O3+3H2SO4 ![]() Fe2(SO4)3+3H2O
Fe2(SO4)3+3H2O
( )④2FeO+4H2SO4(浓) ![]() Fe2(SO4)3+4H2O+SO2↑
Fe2(SO4)3+4H2O+SO2↑
( )⑤2Al+3H2SO4(浓) ![]() Al2O3+3SO2↑+3H2O(Al在浓H2SO4中的变化)
Al2O3+3SO2↑+3H2O(Al在浓H2SO4中的变化)
( )⑥MnO2+4HCl![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
( )⑦2NaCl(s)+H2SO4(浓) ![]() Na2SO4+2HCl↑
Na2SO4+2HCl↑
( )⑧HCOOH浓H2SO4![]() CO↑+H2O
CO↑+H2O
( )⑨二氧化硫气体通过浓硫酸被干燥
( )⑩蘸取浓硫酸在白纸上写字,字迹变黑
( )⑾锌和稀硫酸的反应生成气体
( )⑿常温下,铁和铝在浓硫酸中“钝化”
( )⒀浓硫酸与磷酸钙混合能制得磷酸(磷酸属于弱酸)
( )⒁浓硫酸滴入浓盐酸中产生白雾
查看习题详情和答案>>判定下列酸的作用,将正确答案代号填在题号前面的括号里。
A.酸性 B.氧化性
C.还原性 D.吸水性
E.脱水性 F.难挥发性
( )①Hg+2H2SO4(浓) ![]() HgSO4+SO2↑+2H2O
HgSO4+SO2↑+2H2O
( )②Cu(OH)2+H2SO4 ![]() CuSO4+2H2O
CuSO4+2H2O
( )③Fe2O3+3H2SO4 ![]() Fe2(SO4)3+3H2O
Fe2(SO4)3+3H2O
( )④2FeO+4H2SO4(浓) ![]() Fe2(SO4)3+4H2O+SO2↑
Fe2(SO4)3+4H2O+SO2↑
( )⑤2Al+3H2SO4(浓) ![]() Al2O3+3SO2↑+3H2O(Al在浓H2SO4中的变化)
Al2O3+3SO2↑+3H2O(Al在浓H2SO4中的变化)
( )⑥MnO2+4HCl![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
( )⑦2NaCl(s)+H2SO4(浓) ![]() Na2SO4+2HCl↑
Na2SO4+2HCl↑
( )⑧HCOOH浓H2SO4![]() CO↑+H2O
CO↑+H2O
( )⑨二氧化硫气体通过浓硫酸被干燥
( )⑩蘸取浓硫酸在白纸上写字,字迹变黑
( )??锌和稀硫酸的反应生成气体
( )??常温下,铁和铝在浓硫酸中“钝化”
( )??浓硫酸与磷酸钙混合能制得磷酸(磷酸属于弱酸)
( )??浓硫酸滴入浓盐酸中产生白雾
查看习题详情和答案>>氮循环中的重要物质及其变化
硝酸及其应用
(1)硝酸的主要用途
HNO3可用于制造炸药、染料、塑料、硝酸盐等.
(2)HNO3的物理性质
纯净的硝酸是无色、易________、有________的液体,熔沸点低,密度比水大.
(3)HNO3的化学性质
①具有酸的通性.
②不稳定性:见光受热易分解
4HNO3![]() 4NO2↑+O2↑+2H2O
4NO2↑+O2↑+2H2O
光线越强、温度越高,HNO3越易分解.HNO3越浓,越易分解.
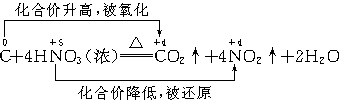
③强氧化性:
能氧化Au、Pt、Ti以外的大多数金属.
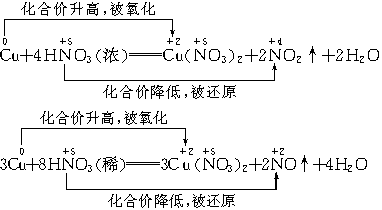
常温下,Fe、Al在浓HNO3中钝化——表面形成________保护膜,阻止了反应的进一步进行.
加热条件下,浓HNO3还能将C、P、S等非金属氧化.