网址:http://m.1010jiajiao.com/timu3_id_145486[举报]
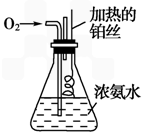
(1)向浓氨水中鼓入空气的目的是_______________________________。
(2)这个反应叫____________,化学方程式为________________________________。
(3)铂丝保持红热,说明此反应是________反应,生成的红棕色气体是__________,该反应的化学方程式是______________________。
(4)实验中,有时看到白烟,此白烟是________,生成的原因是 ________________________________________。
Ⅰ.如图所示,50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L,NaOH溶液在装置中进行中和反应.通过测定反应过程中所放出的热量,可计算中和热,回答下列问题:
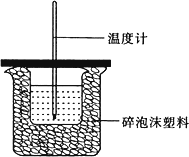
(1)图中装置缺少的仪器是________.
(2)下列说法中不正确的是________.(填字母,下同)
A.若用50 mL 0.55 mol·L-1的Ba(OH)2溶液代替NaOH溶液进行实验,测得的中和热是相同的
B.若用50 mL 0.50 mol·L-1的醋酸溶液代替盐酸进行实验,测得的中和热是相同的
C.若分别用等浓度的硫酸和Ba(OH)2溶液代替盐酸和NaOH溶液进行实验,测得的中和热是相同的
D.NaOH溶液稍过量的原因是让盐酸完全反应
Ⅱ.某学生用0.1 mol·L-1的盐酸标准溶液滴定未知浓度的20.00 mL氨水,用酚酞做指示剂,回答下列问题:
(1)在滴定时,左手握________(填仪器名称)的活塞,右手摇动锥形瓶,眼睛注视________.直到最后加入一滴盐酸后,溶液出现________现象,说明达到滴定终点,记录数据,发现消耗盐酸25.00 mL.
(2)下列操作中可能使所测氨水溶液的浓度数值偏低的是________.
A.酸式滴定管未用标准盐酸润洗,就直接注入标准盐酸
B.滴定前盛放氨水的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)当盐酸与氨水恰好完全反应生成盐时,消耗的盐酸溶液体积V________(填“>”、“<”或“=”)25.00 mL.

四种盐在不同温度下的溶解度(g/
温度 溶解度 盐 | ||||||||
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | —① | — | — | — |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | — |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
(说明:①>
请回答以下问题:
(1)装置的连接顺序应是__________(填字母)。
(2)A装置中盛放的试剂是__________,其作用是__________。
(3)在实验过程中,需要控制D温度在30—
(4)反应结束后,将锥形瓶浸在冷水中析出NaHCO3晶体的原因是____________________
_____________________。用蒸馏水洗涤NaHCO3晶体的目的是除去____________杂质(以化学式表示)。
(5)测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1—2滴酚酞指示剂,用物质的量浓度为c mol·L-1的HCl溶液滴定至溶液由红色到无色(指示![]() +H+
+H+![]()
![]() 反应的终点),所用HCl溶液体积为V1 mL,再加1—2滴甲基橙指示剂,继续用HCl溶液滴定溶液由黄变橙,所用HCl溶液体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)=_______________________________。
反应的终点),所用HCl溶液体积为V1 mL,再加1—2滴甲基橙指示剂,继续用HCl溶液滴定溶液由黄变橙,所用HCl溶液体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)=_______________________________。